Цитоскелет
Раздел посвщённый изучению скелета клетки - цитоскелету
Микротрубочки
Параметры микротрубочек
Время полужизни микротрубочки ~5 мин, во время первой половины митоза ~15c
Диаметр микротрубочки 25нм.
Образование микротрубочек
Структурной единицей микротрубочки является гетеродимер белка тубулина, состоящий из α- и β-субъединиц (53 и 55 кДа), не прибывающих по отдельности, схожие но не идентичные. Каждая из субъединиц имеет сайт для связывания нуклеотида. α-тубулин связывает молекулу GTP, которая не гидролизуется, β-тубулин может связывать GDP или GTP (рис.1). β-тубулин одного гетеродимера связывает GTP и соединяется с α-тубулином другого гетеродимера, при этом GTP гидролизуется до GDP. α-тубулин является GTP-активирующим белком и катализирует гидролиз GTP β-тубулина (рис.2). Таким образом гетеродимеры образуют линейные цепочки – протофиламенты, 13 протофиламентов образуют спиральный циклический комплекс, такие кольца полимеризуются в трубку (рис.3). Фосфорилирование тубулина усиливает полимеризацию.

рис.1 Гетеродимер тубулина. α-тубулин (син.) с сайтом связывания GTP (голуб.). β-тубулин (зел.) с сайтами связывания GTP и GDP (красн.)
Микротрубочки - динамические полярные стр-ры. (+)-конец динамически нестабильный (β-тубулин) и (-)-конец стабилизируется, связываясь с центром организации микротрубочек (см. обзор Центросома).
Тредмиллинг - движение микротрубочек в результате одновременного наращивания одного конца и диссоциации другого конца микротрубочек.
ДНК тубулина в нуклеотид-связывающем домене имеет высококонсервативную последовательность GGGTG(T/S)G.
Бактериальный белок FtsZ - гомолог тубулина является компонентом бактериального цитоскелета и полимеризуется с образованием микротрубочек.
 Микротрубочки
Микротрубочки
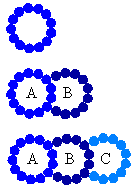
рис.2 Микротрубочки способны образовывать синглет, дублет и триплет.
A микротрубочка дублета или триплета состоит из 13 протофиламентов.
Трубочки B и C состоят из меньшего числа протофиламентов, обычно 10.
Белки соединяющиеся с микротрубочками.
С микротрубочками ассоциируют два вида белков: структурныерные
белки (MAP-microtubuls-associated proteins) и белки транслокаторы.
Присоединение MAP регулируется фосфорилированием, в результате
которого некоторые MAP отсоединяются от микротрубочек.
+TIPS - белки взаимодействующие с (+)-концом
микротрубочки, многие из которых являются моторными белками,
другие обеспечивают взавимодействие с микрофиламентами в
клеточном кортексе, присоединяя микротрубочки к плазматической
мембране. Некоторые +TIPS регулируют динамику микротрубочек
и стабильность (+)-конца, например, XMAP215
семейство белков стабилизирует (+)-конец предотвращая разрушение
и обеспечивая рост микротрубочек.
CLASP - белки обеспечивающие присоединение
димеров тубулина к (+)-концу и ингибируют катастрофины.
Они взаимодействуют с кинетохором - комплексом который соединяет
(+)-конец микротрубочки с хромосомой.
Катастрофины - +TIP белки связывающиеся с (+)-концом микротрубочек
и обепечивающие диссоциацию димеров тубулина. Они способны
активировать гидролиз GTP или изменение конформации протофиломентов
(MCAK - кинезин, располагающийся в кинетохоре
и обеспечивает диссоциацию (+)-конца во время анафазы митоза).
Стасмин - дестабилизирующий белок, находящийся
в раковых клетках. Присоединяется с тубулиновым гетеродимером
затрудняя их полимеризацию. Стасмины ингибируются фосфорилированием.
Катанин - разделяет микротрубочки образуя новый нестабильный
(+)-конец.
НекоторыеMAP соединяют микротрубочки
друг с другом, с мембраной или промежуточными филаментами.
Тип I MAP обнаружен в аксонах и дендритах нервных клеток
и некоторых других имеет несколько повторов KKEX (Lys-Lys-Glu-X)
которые связывают (-)-заряженные участки тубулина.
Тип II MAP также обнаружен в аксонах и дендритах нервных
клеток и некоторых других. Они имеют 3-4 повтора из 18 остатков
последовательности, которая присоединяет тубулин.
Белки взаимодействующие с (+)-концом микротрубочек
APC, Kar9 (Sc)*
APC (adenomatous polyposis coli) - опухолевый супрессор,
являющийся основой для белкового комплекса регулирующего
фосфорилирование b-катенинов.
EB1, Bim1(Sc), Mal3 (Sp)
EB1 (end-binding protein 1) - белок взаимодействующий с
APC.
Nud (An)
Nud (nuclear distribution) - белок регулирующий динеины.
Lis1/NUDF (An), Pac1 (Sc)
Lis (lissencephaly) - нарушение развития человеческого мозга
(гладкий мозг). Белок взаимодействует с динеином регулируя
его функцию.
NUDE (An), R011 (Neurospora
crassa)/Ndl1 (Sc); Nde1, Ndel1
(млекопитающие).
Эти белки взаимодействуют с Lis1 и денеинами и обеспечивают
их функционирование.
Kar3 (Sc)
Kar3 - кинезин, имеющий C-концевой моторный домен и пренадлежит
к семейству Kinesin-14.
Kip2(Sc), Tea2
(Sp), KipA (An)
Кинезины грибов принадлежащие семейству Kinesin-7 включающее
CENP-E - центромерный белок млекопитающих, Kip2 , Tea2 and
KipA
Klp10A (Dm), Klp59C, MCAK
Члены семейства Kinesin-13. Klp10A - предполагаемый гомолог
Kif2A млекопитающих. Klp59C (Dm) - предпоплагаемый гомолог
MCAK млекопитающих. KLP10A и другие члены Kin I
субсемейства кинезинов взаимодействующих с некепированным
(-)-концом микротрубочек веретена деления во время митоза.
Они обеспечивают диссоциацию тубулиновых димеров полюсов
клетки, способствуя тедмиллингу (движению
микротрубочек к полюсам и укорочение микротрубочек во время
анафазы митоза).
Dynactin
Комплекс белков включающий белок p150glued. Динактин связывает
динеин и регулирует его свойства, а такжи присоединяет везикулы
к динеину. p150glued - гомолог NUDMA. nidulans.
CLIP-170, Bik1 (Sc), Tip
(Sp)
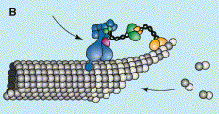
CLIP-170 обеспечивает стабилизацию и рост микротрубочек,
а так же регулирует локализацию динеина.
СLIP-170 - обеспечивает посадку комплекса динеин-динактин,
участвующего в транспорте везикул, на конец микротрубочки.
LIP-170 находится в цитоплазме в неактивной конформации
в которой N-конец связывающийся с микротрубочкой связан
с С-концом той же молекулы. При связывании N-конца с тубулином
или (+)-концом микротрубочки, C-конец освобождается и связывается
с комплексом динеин-динактин через молекулу p150Glued, микротрубочка
стабилизируется. Диненин-динактин освобождается и начинает
движение вдоль микротрубочки (рис.3)
Некоторые токсины и лекарства, некоторые из которых нарушают митоз влияют на полимеризацию и деполимеризацию тубулина:
таксол - противоопухолевое лекарство, стабилизирует микротрубочки.
колхицин связывает тубулин блокируя полимеризацию. Микротрубочки деполимеризуются при высокой концентрации колхицина.
винбластин - усиливает деполимеризацию образуя паракристаллы винбластин-тубулин.
нокодазол - обеспечивает деполимеризацию микротрубочек.
Ассоциация подавляется винбластин, винкристин, колхицин, усиливается – таксол.
Гамма-сома – центр организующий микротрубочки на внешней поверхности ядра.
Микрофиламенты
G-актин
мономер G-актин (глобулярный актин)- ассиметричный
(42кДа) состоит из двух доменов, по мере повышения ионной
силы агрегирует в скрученный в спираль полимер F-актин (фибриллярный
актин).
G-актин имеет участки связывания двухвалентных катионов
и нуклеотидов в физиологических условиях занятые Mg2+
и ATP.
Полимеризация G-актина в F-актин
F-актин обладает полярностью (+) и (-) имеющих
различные свойства.
Молекула G-актина несет прочно связанную АТФ, который при
переходе в F-актин медленно гидролизуется до АДФ – проявляет
свойства АТФ-азы Полимеризация сопровождается гидролизом
АТФ, что не необходимо т.к. полимеризация идет и в присутствии
негидролизуемых аналогов АТФ
Полимеризация состоит из нескольких процессов: нуклеация,
элонгация, диссоциация,
фрагментация, стыковка.
Эти процессы протекают одновременно.
Нуклеация – соединение трех G-актинов –
инициация полимеризации.
Элонгация - наращивание цепи актина путем
присоединения G-актина к (+)-концу F-актина.
Диссоциация - укорачивание цепи. Деполимеризация
актина имеет одинаковую скорость с обоих концов
Фрагментация - в результате теплового движения
F-актин может фрагментироваться.
Стыковка - отдельные фрагменты могут соединяться
друг с другом конец в конец.
При конценрации G>F – одновременно происходит полимеризация
(+) и (–) конца.
Если G<F – происходит полимеризация (+) и деполимеризация
(–)-конца – тредмиллинг – движение F-актина
за счет одновременного наращивания (+)-конца и диссоциации
(-)-конца. При G ~ F – динамическое равновесие - происходит
полимеризация (+) и деполимеризация (–)-конца с затратой
энергии ATP G-актин связ с ATP и полимеризуясь гидролизует
ATP.при критических конц G-актина (+) конец удлиняется,
а (-) – укорачивается
Актиновые микрофиламенты
F-актин – фибриллярный, длина оборота спирали 37
нм, d=6-8нм.
Актинсвязывающие белки
Более 50 белков в цитоплазме связываются с актином выполняя
различные функции: регулируют объем G-актинового пула (профилин),
влияют на скорость полимеризации (виллин), стабилизируют
концы нитей (фрагин, а-актинин), сшивают филаменты др с
др или с др компонентами (виллин, α-актин, спектрин,
MARCKS, фимбрин), разрушают двойную спираль F-актина (гельзолин).
Активность этих белков регулируется Ca2+ и протеинкиназами.
Имеется пять мест действия белков: с мономером
актина, с (+)-концом (оперенный), с (-)-концом (заостренный),
с боковой поверхностью. Актин-связывающие белки могут быть
чувствительны или нечувствительны к Ca2+
1. Белки связывающиеся c мономером актина - подавляют нуклеацию
(профилин, фрагментин - чувствительны к Ca2+).
Профилин с мономером способны надстраивать F-актин, а фрагментин
нет, блокируя и нуклеацию и элонгацию. Не чувствительные
к Ca2+ ДНКазаI и белок связывающийся с витамином
D - функционируют вне клетки.
2. Кепирующие(+)-конец может быть блокирован кепирующими
белками - блокирование элонгации и стыковки, способствуют
нуклеации - появление укороченных филаментов (гельзолин,
виллин, фрагмин)
3. (-)-конец - инициирование нуклеации, подавление стыковки
и элонгации - увеличение числа и уменьшение длины фрагментов.
Акументин в макрофагах, бревин - сывороточный белок вызывает
быстрое снижение вязкости раствора F-актина. Оба белка не
чувствительны к Ca2+
4. Не сшивающие - боковое связывание может как стабилизировать
так и дестабилизировать F-актин Тропомиозин (Ca-независим)
стабилизирует, северин, виллин (Ca-зависим) - связываясь
с F-актином разрезают его.
5. Сшивающие F-актин между собой с образованием геля. Такие
белки индуцируют нуклеацию. Такие белки димерны или имеют
два актин-связывающих домена. α-актин тромбоцитов,
виллин, фимбрин, актиногелин из макрофагов (Ca-независим).
кэпирующие белки - закрывают концы актиновых
филаментов, предотвращая полимеризацию-деполимеризацию,
способствуют прикреплению филамента к мембране.
фаллоидин – яд бледной поганки, связывается
с (-)-концом и ингибирует деполяризацию.
цитохалазин – токсин плесневых грибов присоединяется
к (+) концу, блокируя полимеризацию.
кэпирующие-фрагментирующие белки - фрагментируют
F-актин, вызывая переход геля в золь (гельзолин 90kD активируясь
Ca2+ 10-6M разрывает F-актин и связывается с его концами).
белки связывающие F-актин
| белок | M, kD | рис. | локализация и действие на F-актин |
| фасцин | 55 | филлоподии, ламелоподии, стресс-фибриллы, микроворсинки, акросома |
|
| тропомиозин | 2x35 | стабилизирует F-актин, предотвращая фрагментацию | |
| миозин | 2x260 | скольжение нитей | |
| минимиозин | 150 | движение пузырьков | |
| профилин | 15 | запасение G-актина | |
| скруин | 102 | акросома | |
| вилин | 92 | микроворсинки | |
| дематин | 48 | кортикальная сеть эритроцитов | |
| фимбрин | 68 | адгезион. контакты, микроворсинки связ в пучки | |
| актинин | 2x102 | адгез контакты, микроворсинки связ в пучки | |
| спектрин | 2x265+2x260 | кортик сеть эритроц прикрепление к ПМ | |
| дистрофин | 427 | корт.сеть мыш волокон | |
| ABP120 | 92 | псевдоподии | |
| филамин | 2x280 | псевдоподии, стрессфибриллы сшивает в сети |
Структуры образуемые актином
Клеточный кортекс – сеть из актиновых филаментов
под плазматической мембраной.
Филлоподии
Стресс-фибриллы - образуются, когда у клетки есть
возможность прикрепиться к субстрату
Промежуточные филаменты
ПРОМЕЖУТОЧНЫЕ ФИЛАМЕНТЫ
белки промеж филаментов клетки число M, kD тип
кислые кератины эпит >15 40-57 I
основные кератины эпит >15 53-67 II
десмин мыш 1 53 III
кислый фибриллярный белок глиальн, астроциты 1 50
виментин мезенх, нек эпит 1 57
периферин нервные 1 57
белки нейрофиламентов: аксоны и дендриты IV
NF-L 1 62
NF-M 1 102
NF-H 1 110
интернексин ЦНС 1 66
нестин эпит нервн ткани 1 240
ламин A ядра всех клеток 1 70 V
ламин B 1 67
ламин С 1 67
септамерный мономер?параллельный димер?антипараллельный тетрамер?протофиламент? протофибрилла?ПФ
промежуточные филаменты
d=10нм, (цитокератины, десмин, виментин, кислый фибриллярный глиапротеин (GFAP), нейрофиламент) состоят из базовой стержневой стр-ры – суперспирализованная -спираль, такие димеры ассоциируют антипараллельно, образуя тетрамер, агрегация тетрамеров «голова к голове» дает протофиламент, 8 протофиламентов образ. промежуточное волокно | полимеризация ведет к образ. устойчивых неполярных полимерных молекул
белки связанные с ПФ
белок M, kD локализация
BPAG1 230 полудесмосомы
плакоглобин 3 десмосомы
десмоплакинI 250 десм
десмоплакинII 215 десм
плектин 300 кортек. зона
анкирин 140 кортек. зона
филаггрин 30 цитозоль
рецептор B-ламина 58 ядро
У мутантов мышей отсутствует виментин, мыши при этом живут совершенно нормально.
В растительных клетках цитоскелет представлен микротрубочками и микрофиламентами, промежуточных филаментов нет, но есть ламины
Реснички
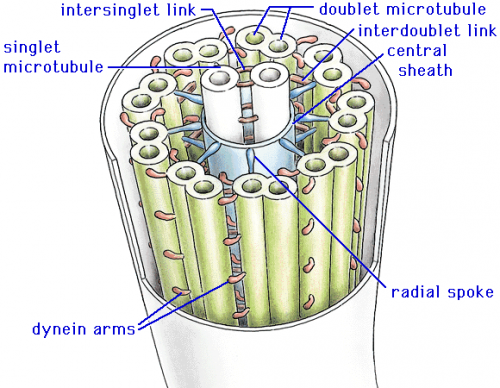
Ресничка - вырост цитоплазмы h=300нм, покрытый пм
аксонема – d=200нм, 9 дублетов микротрубочек, 100, 2 центральные микротрубочки, А-микротрубочка - 13 субъединиц, В-микротрубочка – 11 субъединиц,
базальное тельце - погружено в цитоплазму d = 200 нм, 9 триплетов микротрубочек, имеет ручки, втулку и спицы в проксимальной части.
Скорость движения клеток за счет ресничек может достигать ~5мм/c. Число ресничек в кл трахеи ~300, в клетке инфузории ~14тыс.
кинетоцилии – способные к движению (эпителии, спермии), первичные реснички – не двигаются.