Клетка
Раздел об элементарной единице строения и жизнедеятельности всех живых организмов - клетке.
Апоптоз
Распространенность в природе
Во время нормального развития организма апоптоз возникает в клетках при формировании формы или структуры органа. Например при образовании конечности мыши некоторые клетки подвергаются апоптозу и образуются пальцы.
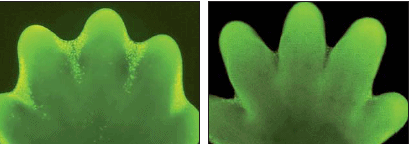
Апоптоз во время нормального развития конечности мыши. Клетки подвергшиеся апоптозу (слева) мечены желтым. Та же конечность (справа) через один день. [Alberts]
Интересно, что некоторые птицы, такие как утка, имеют перепонки между пальцами, тогда как у других птиц, таких как курица, перепонок нет. В раннем эмбриогенезе и курицы и утки имеют перепонки между пальцами. Специфический белок BMP4 образуется в клетках между пальцами, запуская клеточную смерть этих клеток. Другой белок BMP (gremlin) образуется вокруг пальцев у обоих птиц и только у уток образуется также и в клетках перепонок, предотвращая запуск апоптоза в них.
Если добавлять белок gremlin в перепонку эмбрионов курицы, то она не подвергается апоптозу и сохраняется.
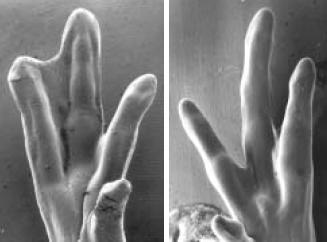 Слева лапка курицы после добавления в перепонку белка Gremlin (перепонка сохранилась), справа контрольный эксперимент без добавления белка (перепонка подверглась апоптозу).
Слева лапка курицы после добавления в перепонку белка Gremlin (перепонка сохранилась), справа контрольный эксперимент без добавления белка (перепонка подверглась апоптозу).
Другим примером апоптоза в нормальном развитии является метаморфоз головастика лягушки. Под воздействием тиреоидного гормона при метаморфозе головастика лягушки, запускается апоптоз и хвост головастика исчезает. [Alberts, 4th edition]
Пути апоптоза в клетке
Существуют два основных пути апоптоза в клетке:митохондриальный путь и путь через рецепторы апоптоза (смерти).
1. Рецепторы апоптоза - семейства белков CD95 (Apo-1 или Fas) и TNF-R (фактор опухолевого некроза). TNF-альфа высоко цитотоксичная молекула, использовалась как лекарство против рака. TNF-R1 рецептор широко распространен и поэтому не может быть избирательным. Другие представители этого семейства (не все) имеют домен клеточной смерти (DD) - домен белок-белкового взаимодействия связывающийся с белком адаптором, таким как FADD. Активация рецепторов апоптоза лигандами (например, CD-95L и TNF-альфа приводит к активации каспазы-8, запуская каскад реакций ведущих к апоптозу.
2. Митохондриальный путь. Митохондрии выполняют центральную роль в апоптозе, при этом наблюдается увеличение проницаемости митохондриальной мембраны. Баланс между про- и анти-апоптозных членов семейства Bcl-2 регулирует выход про-апоптозных веществ из митохондрий, ведущих к запуску апоптоза, таких как AIF, эндонуклеаза G, Smac/DIABLO и цитохром C. Утечка цитохрома-С из митохондрии приводит к образованию апоптосомы в цитоплазме, которая активирует каспазу-9 и запускает клеточную смерть.
Оба пути приводят к активации каспаз и запуску каскада реакций приводящих к гибели клетки.
Каспазы
Каспазы (caspase) - ферменты расщепляющие белки по остаткам аспартата. Они содержат цистеиновые остатки на своих активных центрах. Многие изоформы каспаз ведут к апоптозу. Они могут быть активированы двумя путями: через рецепторы апоптоза и митохондрии.
Первая открытая каспаза - Ced-3 (Cell Death-3), обнаруженная у нематоды C. elegans. Мутация Ced-3 предотвращала гибель 131 клетки в процессе нормального развития нематоды. Гомолог Ced-3 у млекопитающих - интерлейкин-1альфа-преобразующий фермент (ICE) и был позже назван ингибитор каспазы-1.
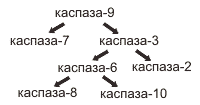 Каскад активации каспаз
Каскад активации каспаз
Известно 14 каспаз, которые подразделяются на инициаторы, эффекторы и стимуляторы. Инициаторы (каспаза-8 и -9) расщепляют и активируют каспазы эффекторы (каспаза-3). Эффекторы расщепляют различные белки, что ведет к гибели клетки. Активация каспаз ведет к запуску протеолитического каскада реакций ведущих к гибели клетки. При этом одни каспазы активируют другие - амплификация сигнала.
Каспаза представляет собой тетрамер, состоящий из двух больших (~20kDa) и двух малых субъединиц (~10kDa). Большая и малая субъединицы образуется в результате расщепления прокаспазы. Каспаза содержат два активных центра QACXG. Ингибирующий домен (DED или CARD) может быть вырезан из каспазы.
Эффекторные каспазы активируются другими каспазами (трансактивация). Инициаторные каспазы активируются автоактивацией, которая происходит при взаимодействии нескольких прокаспаз (например, прокаспаза-8 и DISC). Рецептор апоптоза сам по себе не обладает протеазной активностью.
Активация каспаз ведет к различным последствиям:
каспаза-9 разрушает ядерные поры, что ведет к проникновению в ядро каспаз-3 и -7. Каспаза-3 расщепляет ингибирующую субъединицу ICAD в двух местах. Выпуск CAD приводит к расщеплению ДНК между нуклеосомами.
Каспазы ведут к реорганизации цитоскелета и распаду клетки на апаптозные тельца.
Каспазы - семейство цистеиновых протеиназ, главные эффекторы апоптоза, существуют в клетке как неактивные проформы и зимогены, которые расщепляются на активные формы ферментов, активируя апоптоз.
Лиганд-->рецептор смерти-->активация инициаторов каспаз (каспаза-8, -10)-->каскад активации других каспаз>активация каспаз-3, -6-->инактивация клеточных структур.
Разрушение клеточных структур при апоптозе
Фрагментация хромосомной ДНК неактивный фермент CAD в комплексе с ICAD (ингибитор CAD-фактор фрагментации ДНК) расщепляется каспазой-3 высвобождая CAD, кот разрезает ДНК м-у нуклеосомами
Инактивация ферментов вовлеченных в репарацию ДНК - фермент поли (ADF-ribose) полимераза, или PARP- первый белок обнаруженный как субстрат для каспаз. PARP вовлекается в репарацию ДНК и катализирует синтез (ADF-ribose) и закрепляет на цепи ДНК ломая и изменяя ядерные белки. Способность PARP репарировать разрушения ДНК предотвращается последующим расщеплением PARP каспазой-3
Инактивация белков вовлеченных в репликацию. Каспазы могут инактивировать ДНК топоизомеразу II, способствуя разрушению ДНК.
Разрушение структурных ядерных белков. Каспаза-6 разрушает ламины разрушая ядро, что приводит к конденсации хромосом.
Чувствительность клеток к стимулам изменяется в зависимости от экспрессии про- и анти-апоптозных белков (Bcl-2 белок ингибитора), серьезности стумулов и стадии клеточного цикла
Распад клетки на везикулы, переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой, уменьшение объема клетки, сморщивание цитоплазматической мембраны, конденсация ядра (апоптозные тельца), фагоцитирующиеся макрофагами и клетками-соседями.
Инициаторы апоптоза
внешние сигналы (связывание лиганда индуцирующего смерть рецептором на клеточной пов-ти), быстрый вариант а
гранзим B может доставляться в клетки цитотоксичными T лимфоцитами, когда они узнают инфицированную клетку, активирует каспазы-3, 7, 8 и 10.
клеточный стресс – радиация, химикалии, вирусная инфекции, недостаток фактора роста, ox стресс | кол-во bcl-2 белков определяет кол-во стресса необходимого для запуска а. Если митохондрии не справляются с удалением активных форм O2, последнии инициируют открытие пор во внеш. м-не и выход в цитозоль белка, ответственного за каскад реакций, ведущих к синтезу протеаз, нуклеаз
Митохондрия может быть ключевым регулятором каспазного каскада и апоптоза - избавление от цитохрома С в митохондрии может вести к активации каспазы 9 и затем каспазы 3. Этот эффект достигается через образование апоптосомы – мультипротеинового комплекса включающего цитохром C, Apaf-1, прокаспазу 9 и АТФ
Апоптосома
Цитохром C освобождается из митохондрий, связываясь с цитозольным белком Apaf-1. Это взаимодействие изменяет конформацию Apaf-1 которая стабилизируется связыванием ATP позволяя молекулам Apaf-1 ассоциировать друг с другом в колесоподобный комплекс состоящий из 7 молекул. Apaf-1, цитохром C и ATP - апоптосома, присоединяющая 7 молекул прокаспаз-9. Возможные механизмы:
1. Apaf-1, цитохром C и прокаспаза-9 – комплекс может активировать цитозольную прокаспазу-9 входящую в апоптосому.
2. Две апоптосомы взаимодействуют друг с другом активируя прокаспазу-9.
Оксид азота NO ингибирует апоптоз в лейкоцитах, гепатоцитах, трофобластах и эндотелиальных клетках. Эффект может быть вызван через нитрозилирование и инактивацию каспаз-3, -1, -8. NO взаимодействует с гемом гуанилат циклазы-->синтез сGMP-->активация cGMP-зависимой протеинкиназы-->экспрессия противоапоптозных белков.
bcl-2 - семейство белков
bcl-2 - семейство белков регуляторы апоптоза (bc-2, bcl-XL – противоапоптозные), (Bad, Bax – проапоптозные) | чувствительность клеток к апоптозным стимулам может зависеть от баланса противо- и проапоптозных bc-2 белков | стресс?проапоптозные bc-2 белки перемещаются на пов-ть митох, инактивируя антиапоптозные белки, что приводит к образ пор в митох и выпуск цитохрома с и др про-апоптозных молекул из межм-ного пр-ва-->формируется апоптосома-->активация каспазового каскада.
Проапоптозные члены Bcl-2 увеличивают проницаемость митохондриальной мембраны, что ведет к попаданию проапоптозных белков в цитоплазму. Противоапоптозные представители семейства - уменьшают проницаемость.
Bcl-2 разделяется на три субсемейства.
Bcl-2 субсемейство включает Bcl-2, Bcl-xL и Bcl-w, являющиеся противоапоптозными.
Bax субсемейство включает Bax, Bak и BAD, являющиеся проапоптозными белками. Их последовательности гомологичны регионам Bcl-2 субсемейства - BH1, BH2 и BH3, но не региону BH4.
BH3 субсемейство с единственным представителем - Bid, у которого гомологичен только BH3 регион.У Bid так же отсутствует трансмембранный домен.
Имеется несколько моделей, как Bcl-2 могут регулировать проницаемость митохондриальной мембраны.
Члены Bcl-2 семейства способны формировать гомо- и гетеродимеры. Гетеродимеризация между про- и противо-апоптозными представителями Bcl-2 ингибирует про-апоптозный белок.
Bcl-2 белки так же способны образовывать ионные каналы (Bcl-xL, Bcl-2 и Bax).
По другому механизму Bcl-2 образуют поры в митохондриальной мембране, осуществляющие неспецифический транспорт небольших молекул меньше 1.5kDa, что нарушает синтез ATP и ведеит к клеточной смерти. Так же цитохром-С и AIF могут выходить в цитоплазму и образовывать апоптосомуt. Bax и Bak - индуцируют выход цитохрома-С и AIF из митохондрий.
Сокращения.
DD - death domain
Caspases - (cysteinyl aspartate-specific proteases)
ICE - interleicin converting enzime
Аппарат Гольджи
 Аппарат Гольджи
Аппарат Гольджи
Эндоплазматический ретикулум, плазматическая мембрана и аппарат Гольджи составляют единую мембранную систему клетки, в пределах которой происходят процессы обмена белками и липидами с помощью направленного и регулируемого внутриклеточного мембранного транспорта.
Каждая из мембранных органелл характеризуется уникальным составом белков и липидов.
Строение АГ
АГ состоит из группы плоских мембранный мешков - цистерны, собранные в стопки - диктиосомы (~5-10 цистерн, у низших эукариот >30). Число диктиосом в разных клетках от 1 до ~500.
Отдельные цистерны диктиосомы переменной толщины - в центре ее мембраны сближены - просвет 25 нм, на переферии образуются расширения - ампулы ширина которых не постоянна. От ампул отшнуровываются ~50нм-1мкм пузырьки связанные с цистернами сетью трубочек.
У многоклеточных организмов АГ состоит из стопок цистерн связанных между собой в единую мембранную систему. АГ представляет собой полусферу, основание которой обращено к ядру. АГ дрожжей представлен изолированными единичными цистернами, окруженными мелкими пузырьками, тубулярной сетью, секреторными везикулами и гранулами. У мутантов дрожжей Sec7 и Sec14 наблюдается структура, напоминающая стопку цистерн клеток млекопитающих.
Для АГ характерна полярность его структур. Каждая стопка имеет два полюса: проксимальный полюс (формирующийся, цис-поверхность) и дистальный (зрелый,
транс-поверхность). Цис-полюс – сторона мембраны с которой сливаются пузырьки. Транс-полюс – сторона мембраны от которой пузырьки отпочковываются.
Пять функциональных компартментов АГ:
1. Промежуточные везикуло-тубулярные структуры (VTC или ERGIC - ER-Golgi intermediate compartment)
2. Цис-цистерна (cis) - цистерны расп ближе к ЭР:
3. Срединные (medial) цистерны – центральные цистерны
4. Транс-цистерна (trans) - наиболее удаленные от ЭР цистерны.
5. Тубулярная сеть, примыкающая к трансцистерне - транссеть Гольджи (TGN)
Стопки цистерн изогнуты, так что вогнутая трансповерхность обращена к ядру.
В среднем в АГ 3-8 цистерн, в активно секретирующих клеток может быть больше (в экзокринных клетках поджелудочной железы до 13).
Каждая цистерна имеет цис и транс поверхности. Синтезированные белки, мембранные липиды, гликозилированные в ЭР, попадают в АГ через цис-полюс. Вещества через стопки передаются транспортными
пузырьками отделяющиеся от ампул. При прохождении белков или липидов через стопки Гольджи, они претерпевают серию посттрансляционных модификаций, включающих изменение N-связанных олигосахаридов:
цис: маннозидазаI подравнивает длинные маннозные цепи до М-5
промежуточный: N-ацетилглюкоэаминтрансферазаI переносит N-ацетилглюкозамин
транс: добавляются концевые сахара –остатки галактозы и сиаловая к-та.
Строение Аппарата Гольджи и схема транспорта.
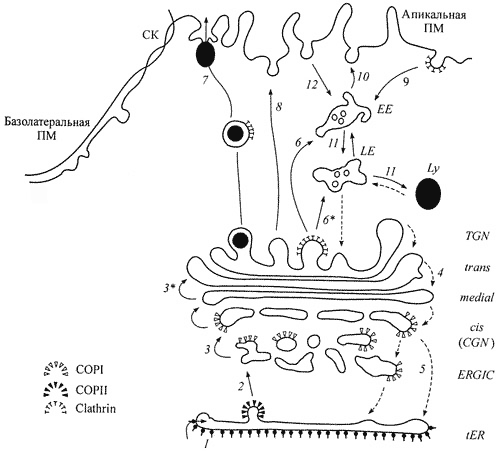 Пять компанентов АГ и схема транспорта: промежуточный (ERGIC), цис, промежуточный, транс и транссеть Гольджи (TGN). 1. Вход синтезированных белков, мембранных гликопротеинов и лизосомных ферментов в цистерну переходного ЭР, прилегающую к АГ и 2 - их выход из ЭР в пузырьках окаймленных COPI (антероградный транспорт). 3 - возможный транспорт карго от тубуло-везикулярных
Пять компанентов АГ и схема транспорта: промежуточный (ERGIC), цис, промежуточный, транс и транссеть Гольджи (TGN). 1. Вход синтезированных белков, мембранных гликопротеинов и лизосомных ферментов в цистерну переходного ЭР, прилегающую к АГ и 2 - их выход из ЭР в пузырьках окаймленных COPI (антероградный транспорт). 3 - возможный транспорт карго от тубуло-везикулярных
кластеров к цис-цистерне АГ в пузырьках COPI; 3* - транспорт карго от более ранних к более поздним цистернам; 4 - возможный ретроградный везикулярный транспорт карго между цистернами АГ; 5 - возврат резидентных протеинов из АГ в tER с помощью пузырьков, окаймленных COPI (ретроградный транспорт); 6 и 6* - перенос лизосомных ферментов с помощью окаймленных клатрином пузырьков соответственно в ранние EE и поздние LE эндосомы; 7 - регулируемая секреция секреторных гранул; 8 - конститутивное встраивание мембранных белков в апикальную плазматическую мембрану ПМ; 9 - опосредованный рецептором эндоцитоз с помощью окаймленных клатрином пузырьков; 10 возвращение ряда рецепторов из ранних эндосом в плазматическую мембрану; 11 - транспорт лигандов из EE в LE и и лизосомы Ly; 12 - транспорт лигандов в неклатриновых пузырьках.
Функции АГ
1. Транспорт - через АГ проходят три группы белков: белки периплазматической мембраны, белки, предназначенные
на экспорт из клетки, и лизосомные ферменты.
2. Cортировка для транспорта: сортировка для дольнейшего транспорта к органеллам, ПМ, эндосомам, секреторным пузырькам происходит в транс-комплексе Гольджи.
3. Секреция - секреция продуктов, синтезируемых в клетке.
3. Гликозилирование белков и липидов: гликозидазы удаляют остатки сахаров - дегликозилирование, гликозилтрансферазы прикрепляют сахара обратно на главную углеводную цепь - гликозилирование.В нем происходят гликозилирование олигосахаридных цепей белков и липидов, сульфатирование ряда ахаров и тирозиновых остатков белков, а также активация предшественников полипептидных гормонов и нейропептидов.
4. Синтез полисахаридов - многие полисахариды образуются в АГ в том числе пектин и гемицеллюлоза, образующие клеточные стенки растений и большинство гликозаминогликанов образующих межклеточный матрикс у животных
5. Сульфатирование - большинство сахаров, добавляемых к белковай сердцевине протеогликана, сульфатируются
6. Добавление маннозо-6-фосфата: М-6-P добавляется как направляюций сигнал к ферментам, предназначенным для лизосом.
ГЛИКОЗИЛИРОВАНИЕ
Большинство белков начинает гликозилироваться в шероховатом ЭР посредством добавления к растущей полипептидной цепи N-связанных олигосахаридов. Если гликопротеин свернут в нужной конформации, он выходит из ЭР и направляется в АГ, где происходит его посттрансляционная модификация.
В гликозилировании секретируемых продуктов принимают участие ферменты - гликозилтрансферазы. Они участвуют в ремоделированиии Т-связанных боковых олигосахаридных цепей и добвлении О-связанных гликанов и олигосахаридных частей протеогликанов гликолипидов.В модификации олигосахаридов участвуют фрменты а-маннозидаза I и II, которые также являются резидентными белками АГ.
Кроме того в АГ происходит гликозилирование липидно-протеиновых мембранных доменнов, называемых рафтами.
Долихолфосфат добавляет углеводный комплекс – 2GlcNAc-9-манноз-3-глюкозы к аспарагину растущего полипептида. Терминальная глюкоза отщепляется в два этапа: глюкозидаза I отщепляет терминальный остаток глюкозы, глюкозидаза II удаляет еще два остатка глюкозы. Затем отщепляется манноза. На этом начальный этап процессинга углеводов в ЭР завершается и белки несущие олигосахаридный комплекс, поступают в АГ
В первых цистернах АГ удаляются еще три остатка маннозы. На этой стадии стержневой комплекс имеет еще 5 маннозных остатков. N-ацетилглюкозаминтрансфераза I добавляет один остаток N-ацетилглюкозамина GlcNAc. От образовавшегося комплекса отщепляется еще 3 остатка маннозы. Состоит теперь из двух молоекул GlcNAc-3-маннозо-1-GlcNAc является стержневой структурой, к которой гликозилтрансферезы добавляют другие
углеводы. Каждая гликозилтрансфераза распознает развивающуюся углеводную структуру и добавляет к цепи свой собственный сахарид.
СЕКРЕЦИЯ
Схема секреции:
Синтезированные в ЭР белки концентрируются в сайтах выхода переходного ЭР благодаря активности коатомерного комплекса COPII и сопутствующих компонентов и транспортируются в промежуточный между ЭР и АГ компартмент ERGIC, из которого они переходят в АГ в отпочковывающихся пузырьках, или по тубулярным структурам. Белки ковалентно модифицируются, проходя через цистерны АГ, на транс-поверхности АГ сортируются и отправляются к местам своего назначения. Секреция белков требует пассивного встраивания новых мембранных компонентов в плазматическую мембрану. Для восстановления баланса мембран служит контитутивный рецепторопосредованный эндоцитоз.
Эндо и экзоцитозный пути переноса мембран имеют общие закономерности в направленности движения мембранных переносчиков к сооответствующей
мишени и в специфичности слияния и почкования. Основным местом встречи этих путей является АГ.
Клеточная сигнализация
Все клетки способны получать информацию об окружении и изменять свой метаболизм в ответ на поступающие сигналы.
Внеклеточные сигналы могут быть химическими или физическими.
Химические сигналы: аминокислоты и их производные, пептиды, белки, нуклеотиды, жирные кислоты и их производные, стероиды, ретиноиды и малые неорганические молекулы.
Физические сигналы: энергия света, тепло, холод, давление и т.д.
Первичные сигналы воспринимаются рецепторами на клеточной поверхности. Вторичные посредники передают сигнал к клеточным компонентам вовлеченным в ответ. Универсальные вторичные посредники: Ca2+, cAMP (cyclic adenosine monophosphate), cGMP (cyclic guanosine monophosphate), диацилглицерол DG и инозитол трифосфат IP3. Рецепторы воспринимающие сигналы гидрофобных молекул, способных проникать через мембрану
самостоятельно располагаются в цитоплазме.
Свойства сигнальных систем
- Специфичность.
- Адаптация. Есть системы модифицирующие рецепторы (метилирование, рибозилирование). Пример отрицательной обратной связи
- Амплификация. Небольшое число сигнальных молекул способно вызывать реакцию во многих клетках. Один рецептор соединенный с лигандом способен активировать множество G-белков, активирующих вторичные посредники (например, cAMP), которые активируют киназы. Киназы способны активировать множество молекул различных ферментов, запускающих клеточный ответ. Таким образом происходит расширение сигнала
- Интеграция. Усреднение результата
G-белки
G-белки промежуточные компоненты сигнального пути, определяющие будет сигнал усилен или ослаблен. Обычно G-белки состоят из трех субъединиц: a субъединица связывает GDP или GTP. При стимулировании рецептора GDP G-белка заменяется GTP, что приводит
к отделению а-субъединицы, которая связывается и активирует ферменты или ионные каналы. При гидролизе GTP до GDP a-субъединица снова объединяется в комплекс.
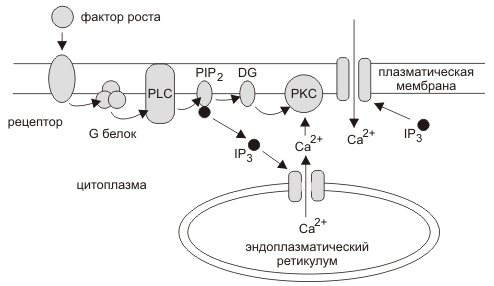
Cигнальный путь вовлекающий вторичные сигналы IP3 и DG. Фактор роста или гормон связывается с рецептором на клеточной поверхности изменяя конформацию рецептора, что стимулирует присоединение GDP к а-субъединице G-белка. а-субъединица диссоциирует от b и g-субъединиц G-белка и GDP меняется на GTP. Активированный G-белок стимулирует фосфолипазу С (PLC), которая гидролизует фосфатидилинозитол 4',5'-бисфосфат (PIP2) до DG и инозитол 1',4'5'-трифосфата (IP3). IP3 активирует ионный канал выпускающий ионы кальция из эндоплазматического ретикулума в цитоплазму. Ионы кальция и DG активируют протеиновые киназы С (PKC) запускающие ответный каскад реакций в клетке.
Другой класс мономерных G-белков состоят из одной субъединицы и называются Ras белками
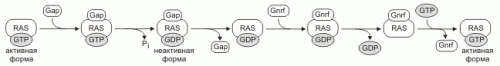
Количество активных Ras определяют GNRF (guanine nucleotide release factors) и GAP (GTPaseactivating proteins). Эти белки обеспечивают обмен GDP на GTP, активируют Ras белки. Гидролиз GTP ингибирует Ras. Некоторые Ras белки негативно регулируются опухолевыми супрессорами.
Киназы и фосфатазы.
Клеточные контакты
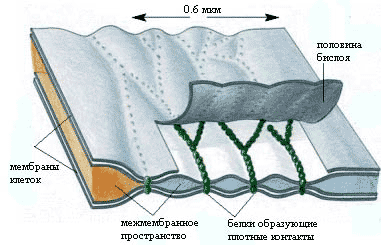
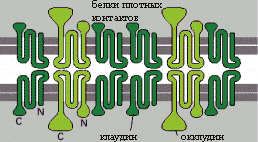
Плотные контакты
Плотные контакты блокируют перемещение макромолекул, жидкостей и ионов между клетками, обеспечивая тем самым барьерную функцию эпителия и регуляцию транспорта веществ через эпителиальный пласт.
Плотные контакты соединяют клетки однослойных эпителиев, особенно железистых и кишечных (клетки выстилки жкт и дыхательной системы). Плотный контакт встречается между всеми типами однослойного эпителия (эндотелий, мезотелий, эпендима).
Плотные контакты препятствуют свободному перемещению и смешиванию функционально различных внутримембранных белков, локализующихся в плазмолемме апикальной и базолатеральной поверхностей клетки, что способствует поддержанию ее полярности.
Плотные контакты имеют вид пояска шириной 0,1-0,5 мкм, окружающего клетку по периметру (обычно у ее апикального полюса).
Для поддержания целостности этих соединений необходимы двухвалентные катионы Mg2+ и Ca2+. Контакты могут динамично перестраиваться (вследствие изменений экспрессии и степени полимеризации окклудина) и временно размыкаться (например, для миграции лейкоцитов через межклеточные пространства).
Фокальные контакты
Встречаются у многих клеток и особенно хорошо изучены у фибробластов.
Они построены по общему плану со сцепляющими лентами, но выражены в виде небольших участков - бляшек на плазмолемме. В этом случае трансмембранные линкерные белки-интегрины специфически связываются с белками внеклеточного матрикса (например с фибронектином). Со стороны цитоплазмы эти же гликопротеиды связаны с примембранными белками, куда входит и винкулин, который в свою очередь связан с пучком актиновых филаментов. Функциональное значение фокальных контактов заключается как в закреплении клетки на внеклеточных структурах, так и создании механизма, позволяющего клеткам перемещаться.
Щелевые контакты

Щелевые контакты – щель 2-4нм, состоят из белковых каналов обеспечивают прохождение веществ до 1кДа.
Коннексоны – регулируемые каналы, состоят из 6 коннексинов – белковые субъединицы М=26-54 кДа.
Каналы перекрываются при попадании в клетку Ca2+ при повреждении. Обмен тимином через коннексоны при отборе гибридных клеток усложняет отбор - т.к. два коннексона соседних клеток образуют канал по которым тимин передается из клетки в клетку.
Через коннексоны передаются электрические сигналы и малые регуляторные молекулы (например, cAMP, InsP3, аденозин, ADP и ATP). Коннексины - нестабильные белки, живущие несколько часов.
Присутствуют практически во всех клетках.
Имеется 20 различных коннексинов у мыши и 21 у человека. Многие клетки образуют несколько видов коннексинов, которые способны полимеризоваться в различных комбинациях. Например, кератиноциты экспрессируют Cx26, Cx30, Cx30.3, Cx31, Cx31.1 и Cx43; гепатоциты - Cx26 и Cx32; кардиомиоциты - Cx40, Cx43 и Cx45. Некоторые коннексины могут заменять другие в случае мутаций. Гетеромерные коннексоны (состоящие из разных коннексинов) Cx26/Cx32 в клетках печени, Cx46/Cx50 в хрусталике и Cx26/Cx30 коннексоны в улитке уха.
Объединение шести коннексинов двух типов может образовывать 14 вариантов коннексонов, из которых может образоваться 142=196 различных вариантов каналов!
Различные типы коннексинов человека и мыши.
| человек | Cx23 | Cx25 | Cx26 | Cx30.2 | Cx30 | Cx31.9 | Cx30.3 | Cx31 | Cx31.1 | Cx32 | - | Cx36 | Cx37 | Cx40.1 | Cx40 | Cx59 | Cx43 | Cx45 | Cx46 | Cx47 | Cx50 | Cx62 |
| мышь | Cx23 | - | Cx26 | Cx29 | Cx30 | Cx30.2 | Cx30.3 | Cx31 | Cx31.1 | Cx32 | Cx33 | Cx36 | Cx37 | Cx39 | Cx40 | - | Cx43 | Cx45 | Cx46 | Cx47 | Cx50 | Cx57 |
Коннексины - политопные интегральные мембранные белки 4 раза пересекающий мембрану, имеющие две внеклеточные петли (EL-1 и EL-2), цитоплазматическую петлю (CL) с N-концом (AT) и C-концом (CT) вдающимися в цитоплазму.
Специфические N- и E-кадгерины обеспечивающие адгезию клеток, что способствует образованию каналов между соседними клетками.
Белки взаимодействующие с коннексонами Cx43: v-, c-src киназы, киназа С, MAP киназа, Cdc2 киназа, казеин киназа 1, киназа A, ZO-2, ZO-1, b-катенин, Дребрин, a-, b-тубулин, кавеолин-1, NOV, CIP85.
С коннексонами способны взаимодействовать различные белки, например, киназы, фосфорилирующие коннексины и меняющие их свойства, что может регулировать работу канала. С коннексонами
так же взаимодействют тубулины (белки микротрубочек), что может способствовать транспорт различных веществ вдоль микротрубочек непосредственно к каналу. Белок дребрин взаимодействует с коннексинами и с микрофиламентами, что указывает на взаимосвязь каналов и организации цитоскелета клетки.
Коннексоны могут закрываться при действии тока, pH, напряжения мембраны, Ca2+.
Десмосомы
 Десмосомы – соединяют клеточную мембрану с промежуточными филаментами, формируя сеть устойчивую к растяжениям.
Десмосомы – соединяют клеточную мембрану с промежуточными филаментами, формируя сеть устойчивую к растяжениям.
Цитокератиновые филаменты
Десминовые филаменты
Пластинка прикрепления иммеет дисковидную форму (диаметр ~0,5 мкм и толщиной 15 нм) и служит участком прикрепления к плазматической мембране промежуточных филаментов.
Состоит из белков - десмоплакин, плакоглобин, десмокальмин.
Межклеточная щель в области десмосомы шириной 25 нм заполнена белками десмоколлинами и десмоглеинами - Са2+-связывающие адгезивные белки, взаимодействующие с пластинками прикрепления.
Полудесмосомы
Полудесмосомы – прикрепляют базальную часть плазматической мембраны эпителиальных клеток к базальной мембране.
Септированные контакты
Плазмодесмы
Этот тип межклеточных связей встречается у растений. Плазмодесмы представляют собой тонкие трубчатые цитоплазматические каналы, соединяющие две соседние клетки. Диаметр этих каналов обычно составляет 20-40 нм. Ограничивающая эти каналы мембрана непосредственно переходит в плазматические мембраны соседствующих клеток. Плазмодесмы проходят сквозь клеточную стенку, разделяющую клетки.
Внутрь плазмодесм могут проникать мембранные трубчатые элементы, соединяющие цистерны эндоплазматического ретикулума соседних клеток.
Образуются плазмодесмы во время деления клетки, когда строится первичная клеточная оболочка. У только что разделившихся клеток число плазмодесм может быть очень велико (до 1000 на клетку), при старении клеток их число падает за счет разрывов при увеличении толщины клеточной стенки.
C помощью плазмодесм обеспечивается межклеточная циркуляция растворов, содержащих питательные вещества, ионы и другие соединения. По плазмодесмам могут перемещаться липидные капли Через плазмодесмы происходит заражение клеток растительными вирусами. Однако эксперименты показывают, что свободный транспорт через плазмодесмы ограничивается частицами с массой не более 800 Да.
Интердигитации
Интердигитации - межклеточные соединения, образованные выпячиваниями цитоплазмы одних клеток, вдающимися
в цитоплазму других. За счет интердигитаций увеличивается прочность соединения клеток и площадь их контакта.
Клеточный транспорт
Раздел посвящённый процессу клеточного транспорта, который принимает участие во многих сферах жизнедеятельности клетки.
Везикулярный транспорт
Пути транспорта белков в клетке
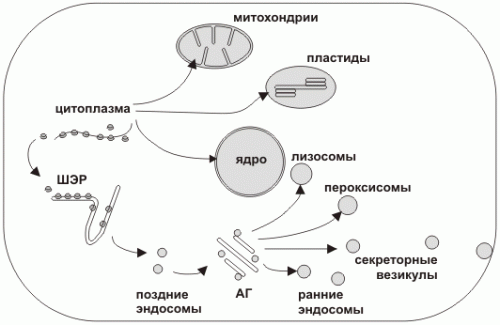 Пути транспорта в клетке
Пути транспорта в клетке
Синтез белка всегда начинается в цитоплазме. Окончание синтеза происходит в цитоплазме либо на шероховатом эндоплазматическом ретикулуме (ШЭР).
Можно условно выделить два пути транспорта белка в клетке:
1. Из цитоплазмы в некоторые органеллы (ядро, пластиды, митохондрии)
2. Большой путь везикулярного транспорта из ШЭР через аппарат Гольджи (АГ) к другим органеллам (лизосомы, пероксисомы) и через секреторные везикулы во внеклеточную среду. Поскольку синтез всех белков начинается в цитоплазме, а конечная локализация каждого белка может быть различна внутри полипептида имеется система сигналов определяющая его транспортный путь. Первичный сигнал определяет путь из цитоплазмы (в ШЭР, в ядро, в митохондрию или в пластиду), вторичный сигнал определяет дальнейшее направление, например, внешняя или внутренняя мембрана митохондрии или матрикс; лизосома, пероксисома или секреторная гранула.
Сигнальные последовательности белков
Сигнальные последовательности имеют длину 3-80 аминокислот узнаются специфическими рецепторами на мембранах различных компартментов клетки.
Сигнальная последовательность ЭР - гидрофобный участок 5-15 аминокислот на N-конце полипептида.
Сигнал митохондриальных белков 20-80 аминокислот состоящий из спирали и торчащих концов - (+)-заряженного и гидрофобного. 5 (+)-заряженных аминокислот для транспортировки в ядро. Пероксисомные белки имеют последовательность на С-конце Ser-Lys-Leu-COOH.
Имеется класс сигнальных последовательностей которые не позволяют белку достигшему определенной локализации транспортироваться дальше. Например, мотив Lys-Asp-Glu-Leu-COOH (KDEL) не позволяет белкам покидать эндоплазматический ретикулум.
Одна из функций гладкого ЭР - удержание кальция готового для выпуска в цитозоль при стимуляции клетки. Кальретикулин - белок удерживающий ионы кальция. Первые 17 аминокислот включают 14 гидрофобных (синие) - сигнальная последовательность для проникновения в ЭР из цитозоля. Последние четыре аминокислоты KDEL удерживают белок в ЭР.
(NH2)MLLSVPLLLGLLGLAVAEPAVYFKEQFLDGDGWTSRWIESKHKSDFGKFVLSSGKF
YGDEEKDKGLQTSQDARFYALSASFEPFSNKGQTLVVQFTVKHEQNIDCGGGYVKLFP
NSLDQTDMHGDSEYNIMFGPDICGPGTKKVHVIFNYKGKNVLINKDIRCKDDEFTHLYTLIVRP
DNTYEVKIDNSQVESGSLEDDWDFLPPKKIKDPDASKPEDWDERAKIDDPTDSKP
EDWDKPEHIPDPDAKKPEDWDEEMDGEWEPPVIQNPEYKGEWKPRQI
DNPDYKGTWIHPEIDNPEYSPDPSIYAYDNF
GVLGLDLWQVKSGTIFDNFLITNDEAYAEEFGNETWGVTKAAEKQMKDKQDEEQRL
KEEEEDKKRKEEEEAEDKEDDEDKDEDEEDEEDKEEDEEEDVPGQAKDEL(COOH)
сервер для предсказания сигнальных последовательностей белков
Некоторые белки имеют различные локализации в клетки. Существует несколько путей транспортировки идентичных полипептидов в различные компартменты клетки [Karniely, 2005]:
1. Несколько сигнальных последовательностей в одном полипептиде преднозначенные для разных компартментов. Каталаза А дрожжей имеет две сигнальные последовательности - для митохондрий и пероксисом, причем количество фермента в этих органеллах зависит от состава среды. Некоторые цитохромы имеют два сигнала - митохондриальный и ЭР. Митохондриальный сигнал запускается после посттрансляционного фосфорилирования белка. Известно, что белок-предшественник амилоида болезни Альцгеймера также имеет два сигнала локализации - ЭР и митохондрий.
2. Одна сигнальная последовательность узнается различными рецепторами на поверхности компартментов. Например, некоторые белки митохондрий и хлоропластов имеют общую сигнальную последовательность, которая более гидрофобна чем специфические сигналы.
3. Сигнал может быть блокирован другим белком. Апуриновая/апиримидиновая эндонуклеаза 1 (Apn1) - основной фермент эксцизионной репарации репарации ДНК в ядре и митохондриях. С-конец имеет сигнал ядерной локализации (NLS), за которым идет сигнал митохондриальной локализации. белок Pir1 взаимодействует с С-концом Apn1 блокируя NLS.
4. Сигнал может быть блокирован специфическим сворачиванием белка. Аденилат-киназа дрожжей Aky2 локализуется в цитоплазме и в небольшом количестве в межмембранном пространстве митохондрий, имеет две сигнальные последовательности, активность которых зависит от конформации белка.
5. Сигнал может быть блокирован после модификации полипептида. Фосфорилированный цитохром CYP2B1, взаимодействует с цитозольным шапероном Hsp70, что приводит к конформационным изменениям и переключает одну сигнальную последовательность на другую.
6. Одна РНК может иметь два сайта инициации трансляции при этом образуются два белка - один с сигнальной последовательностью, другой без нее, что определит различную локализацию белков в клетке. В другом случае может образовываться две различные РНК кодирующие два идентичных белка, но у одного будет сигнальная последовательность, а у другого нет.
Транспорт в ядро
Транспорт в митохондрии и пластиды
Митохондрии и пластиды имеют собственную ДНК и самостоятельно синтезируют некоторые белки. Однако многие из основных белков митохондрий и пластид синтезируются в цитозоле.
Белки проникающие в митохондрии должны нести сигнал, определяющий локализацию - внутрення или наружная мембрана, или матрикс.
Белки преднозначенные для матрикса несут сигнал на N-конце, который узнается рецепторами на внешней мембране. Рецептор связан с комплексом переноса белка, который разворачивает белок и переносит его через мембрану. После переноса белка сигнальная последовательность отрезается и белок снова сворачивается.
Белки шапероны связываются с вновь синтезированным белком предотвращая его сворачивание.
Шаперонины связываются с белком после его транспортировки к месту доставки и способствуют правильному сворачиванию.
В ответ на различные стрессовые воздействия (например повышение температуры) в клетке синтезируются шапероны называемые белками теплового шока - hsp (heat-shock proteins), которые стабилизируют клеточные белки. Hsp обнаружены во всех клеточных компартментах эукариот и у бактерий.
Везукулярный транспорт

Из одной органеллы в другую перемещение происходит в везикуле или на ее поверхности в виде интегральных белков.
Донорый компартмент – органелла от которой отрывается мембрана в составе везикулы, акцепторный компартмент – принимает везикулу.
конститутивная секреция – происходит постоянно и не зависит от внешних сигналов.
регулируемая секреция – под ПМ происходит накопление пузырьков, которые сливаются с ПМ при наличии внешних сигналов – гормоны, нервы – и повышении конц. Ca2+ до 1мкм
ретроградный транспорт – возвращение рецепторных белков и липидов из АГ в Эр - восполнение мембраны ЭР.
антероградный транспорт – растворимые грузовые белки двигаются по секреторному пути ЭР→ пузырек?цис-Гольджи?пузырек?транс-Гольджи?пузырек?органелла или секреция
Окаймленные везикулы - покрыты белками, кот узнают и концентрируют специфич. м-ные белки и отделяют м-ну пузырька, формируют решетку и придают форму везикуле: клатриновые, COPI, COPII:
Клатриновые везикулы – ~0,1мкм, транспорт из АГ и ПМ,клатрин - 3типа, 3 большие и 3 малые субъединицы формирующие трискелетон – собирающиеся на поверхности м-ны со стороны цитоплазмы в пента- и гексагоны, кот спонтанно формируют сферу. Адаптин – связывает клатрин с м-ной и ловит различные трансм-ные белки в том числе грузовые рецепторы, кот. захватывают р-римые грузовые белки, кот попадают внутрь везикулы. Имеетя по крайней мере 4 типа адаптинов
динамин - GTP-аза, р-римый цитоплазматический белок, образует кольцо на отделяющейся клатриновой везикуле – регулирует кол-во клатрина отщепляющееся вместе с м-ной в составе везикулы, ассоциирует другие белки помогающие выпучить м-ну и белки модификаторы липидов, изменяющие локально липидный состав м-ны для выпучивания
После отделения везикулы от м-ны клатрин и адипин отделяют шапероны - ATP-азы hsp70 семейства. Ауксилин – прикрепляется к везикуле и активирует АТФ-азу. Т.к кайма формирующейся везикулы сущ. дольше чем кайма отделенной – имеется стабилизирующий механизм. Клатриновая оболочка обеспечивает значительную силу для изгибания м-ны, т.к. везикулы из внутриклеточных компартментов образуются на уже выпученной м-не
COP-I – транспорт от АГ и ЭР, 8субъединиц, GTP-белок – фактор рибозилирования АДФ –ARF – транспорт
COP-II – транспорт из АГ и ЭР, 5 субъединиц
Везикулы мб не только сферические, часто образуются трубчатые везикулы в которых высокое соотношение S/V
Образование клатриновых и COP везикул регулируется GTP-связывающими белками, которые могут находится в активном GTP- и неактивном GDP-состоянии
Два класса белков обменивают GDP-GTP: GEF-гуанин-нуклеотид-фактор обмена активирует белки заменяя GDF?GTF, GAP- белок активирующий GTP-азы – инактивирует GTP-связывающие белки меняя GTP?GDP.
GTP-азы необходимые для сборки окаймленных везикул перед сборкой пузырьков: мономерные GTP-связывающие белки (GTP-азы):
ARF-белки – необх для клатриновой и COP сборки на пов-ти м-ны АГ. Sar1 белок, необходим для COPII сборки на на ЭР м-не
тримерные (G белки).
GTP-азы находятся в цитозоле в неактивном состоянии, перед сборкой GEF встраивается в м-ну ЭР и связывает цитозольный SarI, кот обменивает GDF?GTP. В GTP состоянии SarI встраивается остатком жирной к-ты в м-ну ЭР. Ассоциирует белки об-ки и инициирует отпочковывание везикулы. GTP-азы попавшие в м-ну активируют фосфолипазу D, кот преобразует фосфолипиды в фосфотидную к-ту, что усиливает связывание оболочных белков. Вместе белок-белковые и белок-липидные взаимодействия изгибают м-ну
SNARE – белки – отвечают за слияние донорной и акцепторной м-н, более 20, каждая на специфич пов-ти м-ны, трансмембранные белки на пов-ти везикулы - v-SNAR, на пов-ти донора – t-SNAR. Взаимодействуя v- и t-SNAR обвиваются др на друга в транс-SNAR-комплекс, обеспечивающий слияние м-н. SNF-белок разрушает транс-SNAR-комплексы – цитозольный шаперон ATP-аза, использует адаптирующие белки для связывания с комплексом-SNAR
Rab-белки – мономерные GTP-азы, более 30, каждая органелла имеет хотя бы один Rab на м-не со стороны цитоплазмы, регулируют стыковку везикул и связывание v-SNAR-ов и t-SNAR-ов необходимых для слияния м-н. В состоянии GDP-не активны, нах в цитозоле, в состоянии GTP-активны и переходят на пов-ть м-ны органеллы или везикулы. В активном состоянии Rap связываются с м-ной липидным якорем и собирают другие белки участвующие в слиянии м-н
неактивный Rab-GDP связан с GDI – GDP-диссоциирующий ингибитор. Rab-GDP связывается с GEF-гуанин нуклеотид меняющий фактор, связанный с м-ной донорного компартмента – меняет GDP на GTP. Rab-GTP связывается с м-ной формирующейся везикулы и ассоциирует v-SNARE, которые в составе везикулы транспортируются к органелле и связываются с Rab-эффекторами и t-SNARE, связанными с м-ной акцепторного компартмента и обеспечивают слияние м-н
белок органелла
Rab1 ЭР и АГ
Rab2 цис-АГ
Rab3A синаптич везикулы, секрет гранулы
Rab4 ранние эндосомы
Rab5A ПМ, клатриновые везикулы
Rab5C ранние эндосомы
Rab6 промежуточный- и транс-АГ
Rab7 поздние эндосомы
Rab8 секреторные везикулы (базолатеральные)
Rab9 поздние эндосомы, trans-АГ
Слияние м-н происходит не только при везикулярном транспорте: слияние спермия с яйцом, слияние миобластов во время развития мышечной клетки.
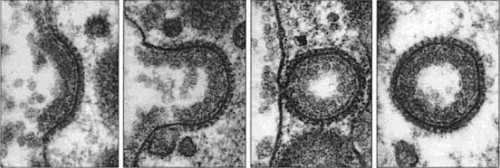 Образование клатринового пузырька. Диаметр клатринового пузырька ~0,3 мкм
Образование клатринового пузырька. Диаметр клатринового пузырька ~0,3 мкм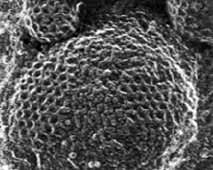 клатриновая везикула
клатриновая везикула
Транспорт малых молекул
ТРАНСПОРТ ЧЕРЕЗ МЕМБРАНУ МАЛЫХ МОЛЕКУЛ
унипорт-независимый перенос, симпорт-одновременный, однонаправленный перенос, антипорт-одновременно антинаправленный транспорт | симпорт и антипорт - контранспорт - скорость процесса зависит от двух переносимых в-в
пассивный транспорт - идущий по градиенту концентрации и/или по электрическому градиенту - простая диффузия, канальный транспорт, облегченная диффузия
простая диффузия - липидная м-на обладает малой проницаемостью для ионов и большинства полярных молекул (исключение вода). Неполярные диффундируют Н2О, CO2, O2. Коэффициенты проницаемости для низкомолекулярных соединений коррелируют с отношением их растворимости в неполярных растворителях к растворимости в воде. Эта зависимость дает основание думать, что низкомолекулярные соединения проходят сквозь двуслойную липидную мембрану следующим образом: сначала они теряют окружающую их гидратную оболочку, затем растворяются в углеводородном внутреннем слое мембраны, после чего диффундируют через этот внутренний слой к другой стороне мембраны, где вновь растворяются в воде.
каналы - трансм-ные белки формирующие в м-не сквозные проходы - индиферентные (всегда открыты - каналы чувствительные к давлению), аллостерические (химически регулируемые - при наличии лиганда никотиновый ацетилхолиновый рец-р, рец-р -аминомаслянной к-ты, рец-р глицина) и потенциал-зависимые (при изменении м-ного потенциала Na+-канал, K+-канал, Ca2+-канал)
облегченная диффузия осущ белками переносчиками, кот специфич связывают и переносят молекулы через липидный бислой, путем изменения конформации
активный транспорт - требующий затрат энергии:
первично-активные -непосредственно использует энергию- сопряженные с ох-red р-циями (цитохром с-оксидаза), сопряженные с поглощ. hv (бактериородопсин), АТФ-азы (Na+/K+-АТФ-аза, Ca2+-АТФ-аза, Н+-АТФ-аза, K+-АТФ-аза, H+/K+-АТФ-аза
вторичноактивные по градиенту, созданному в процессе первично-активного транспорта - контранспорты – симпортеры (лактозопермеаза), антипортеры (белок полосы 3)
транспорт некоторых сахаров и аминокислот внутрь животных клеток обусловливается градиентом Na+ через плазматическую мембрану. Всасывание глюкозы в клетки кишечника и почек достигается с помощью системы симпорта, в которой глюкоза и ионы Na+ связываются с различными участками на белке-переносчике глюкозы (рис. 56). Na+ стремится войти в клетку по своему электрохимическому градиенту и как бы "тащит" глюкозу внутрь за собой. Чем выше градиент Na+, тем больше скорость всасывания
глюкозы. И наоборот, если концентрация Na+ во внеклеточной жидкости заметно уменьшается, транспорт глюкозы останавливается. Ионы Na+, проникающие в клетку вместе с глюкозой, выкачиваются обратно Na+,К+-АТФазой, которая, поддерживая градиент концентрации Na+, косвенным путем контролирует транспорт глюкозы. В плазматических мембранах многих животных клеток существует, по крайней мере, 5 различных белков переносчиков аминокислот, которые действуют как системы симпорта, перенося одновременно ионы Na+, причем каждый из этих белков специфичен для группы родственных аминокислот. У бактерий большинство систем активного транспорта, приводящихся в действие ионными градиентами, использует в качестве котранспортируемого иона Н+, а не Na+. В частности, активный транспорт большей части сахаров и аминокислот в бактериальные клетки обусловлен градиентом Н+ через плазматическую мембрану. Наиболее хорошо изученный пример такого рода - это трансмембранный белок переносчик лактозы (пермеаза, или М-белок), состоящий из одной полипептидной цепи (30 кДа) и осуществляющий Н+-зависимый симпорт: с каждой транспортируемой в клетку молекулой лактозы переносится один протон.
векторный транспорт - способ активного транспорта - молекулы, проникшие в клетку пассивно, химически модифицируются с затратой энергии, так что модифицированные молекулы уже не могут выйти обратно через тот же канал. Встречается у бактерий при транспорте сахаров: при переносе через плазматическую мембрану сахара фосфорилируются, становятся заряженными и не могут выйти обратно, поэтому они начинают накапливаться в клетке. При этом концентрация нефосфорилированных сахаров внутри клетки остается очень низкой, и сахара продолжают поступать в клетку по градиенту концентрации. Механизм сопряженного с транспортом фосфорилирования сахаров у бактерий довольно сложен: в нем участвуют, по крайней мере, четыре разных мембранных белка, а в качестве донора фосфатной группы используется не АТФ, а фосфоенолпируват
ТРАНСПОРТ ЧЕРЕЗ МЕМБРАНЫ МАКРОМОЛЕКУЛ
ТРАНСПОРТ БЕЛКОВ через мембраны
пориновый комплекс – 125000кДа транспорт ч-з ядерную м-ну цитозольных белков, сигнальные посл-ти связ с пк и переносятся с сохранением третичной стр-ры
белки-переносчик – транспорт из цитоплазмы в органеллы, белковые комплекся переносятлинейные пептиды ч-з биомембраны энергозависимым образом посредством связывания сигнальной посл-ти с рецептором, разворачивание и сворачивание белка контролируется шаперонами
Клеточный цикл
Раздел посвящённый важнейшему процессу в жизни каждой клетки - клеточному циклу
Контроль клеточного цикла
Участники контроля клеточного цикла
Контрольные точки клеточного цикла
Контроль различных этапов клеточного цикла
Циклин-зависимые киназы
Циклины
Субстраты циклинов
APC комплекс
Ингибиторы комплексов Cdk-циклин
Участники контроля клеточного цикла
Клеточный цикл контролируется путем взаимодействия трех типов
белков: циклинзависимые киназы (Cdk), циклины
- белки, взаимодействующие с Cdk c образованием комплексов
и ингибиторы комплексов Cdk-циклин.
Циклинзависимые киназы (Cdk) - ферменты фосфорилирующие другие
белки, изменяют их функцию. Клеточный цикл контролируется изменением
активности Cdk, которая регулируется периодическим образованием
и распадом их регуляторных субъединиц - циклинов. Смена синтезов
и разрушений различных циклинов обеспечивает переходы и протекания
различных фаз клеточного цикла. При этом концентрация Cdk
постоянна в течении всего клеточного цикла. В разные фазы
клеточного цикла образуются разные циклины, которые связываясь
с Cdk образуют различные Cdk-циклиновые комплексы. Эти комплексы
регулируют разные фазы клеточного цикла и поэтому называются
G1-, G1/S- , S- и М-Cdk (рис.1).

рис.1 Концентрации различных комплексов Cdk-циклин
в клеточном цикле.
Контрольные точки клеточного цикла
1. Точка выхода из G1-фазы, называемая
Старт - у млекопитающих и точкой рестрикции
у дрожжей. После перехода через точку рестрикции R в конце
G1 наступление S становится необратимым, т.е. запускаются
процессы ведущие к следующему делению клетки.
2.
Точка S – проверка точности репликации.
3.
Точка G2/M-перехода – проверка завершения репликации.
4. Переход от метафазы к анафазе митоза.

Контроль различных этапов клеточного
цикла
ARC подавляет S- и M-циклины и не подавляет G1/S-циклины.
В G1-фазе работают различные ингибиторы Cdk.
Внутренние и внешнии сигналы приводят к образованию G1/S-
и S-циклинов и активации G1/S–Cdks.
Активность G1/S–Cdk увеличивается потому что G1/S циклины
не атакуются APC и потому что G1
Cdk ингибиторы так же не действуют на G1/S–Cdks
(у мух и дрожжей) или удаляются от G1/S–Cdks другими
механизмами (у млекопитающих).
S-Cdk инактивирует ингибиторы Cdk и подавляет ARC, которые
в G1-фазе подавляли S-Cdk. S-Cdk фосфорилируют
различные белки, что ведет к началу дупликации ДНК и S-фазы.
После начала S-фазы S/G1-Cdk обеспечивают собственную
инактивацию.
В конце S-фазы, в G2-фазе начинают накапливаться
М-Cdk, приводящая к вступлению клетки в митоз. М-Cdk активирует
ARC-комплекс, управляющий метафазно-анафазным переходом. Основная
функция ARC-комплекса состоит в разрушении когезинов, приводящее
к началу расхождения хромосом
Циклин зависимые киназы Cdk1-5 в клетках млекопитающих
Cdks активируется при связывании с циклинами (так же как фосфориляция
и дефосфориляция киназ). Cdks-фосфорилируют белки участвующие
в кл цикле
M-phase Cdk (M-Cdk) запускают каскад белковых фосфориляций,
запускающих М-фазу к.ц. (конденсация хромосом, разрушение
ядра, перестройка АГ иЭР, потеря адгезии с большинством других
клеток и внеклеточному матриксу, реорганизация цитоскелета)
anaphase-promoting complex (APC) регулятор митоза – инициация
разделения и расхождения хромосом и инактивация М-Cdk в конце
митоза
При выходе из G0 под действием факторов роста начинает
синтезироваться Cdk2-циклинD: распознает в-ва, регулирующие
ферменты синтеза белков, необходимых для репликации ДНК. В
это же время выявляются Cdk4-циклинD, и Cdk5циклинD
циклин-cdks
запускает М-стадию кц, деградация циклина снижает активность
cdks
Cdk2-циклинE появляется в G1 и достигает max
на границе G1-S, после чего его концентрация
резко снижается
Cdk2-циклинА появляется в промежутке G1-S и присутствует
в высокой концентрации на протяжении S
Сdk2-циклинB в конце G2 до М – резко разрушается
в каждой стадии синтезируются свои циклины M-циклины запускают
события митоза, G1/S-циклины – связывают цзк
в конце G1 подготавливает кл к S-фазе, S-циклины
– связывают цзк, запуская репликацию, G1-циклины
обеспечивают прохождение через точку рестрикции.
Регуляция репликации
Перед началом репликации Sc ORC-комплекс (origin recognition
complex) садится на ori - точку начала репликации. Cdc6 представлен
во всем клеточном цикле, но его концентрация возрастает вначале
G1, где он связывается c ОRC комплексом, к которому затем
присоединяются Mcm белки с образованием pre-replicative complex
(pre-RC). После сборки pre-RC клетка готова к репликации.
Для инициации репликации S-Cdk соединяется с протеинкиназой
(?), которая фосфорилирует pre-RC. При этом Cdc6 диссоциирует
от ОRC после начала репликации и фосфорилируется, после чего
убиквитинируется SCF и деградирует. Изменения в pre-RC препятствуют
повторному запуску репликации. S-Cdk так же фосфорилирует
некоторые Mcm белковые комплексы, что запускает их экспорт
из ядра. Последующая дефосфориляция белков вновь запустит
процесс образования pre-RC.
Регуляция митоза
В эмбриональных клетках синтез М-циклина постоянен во всем
клеточном цикле и накопление его происходит из-за уменьшения
деградации. У большинства клеток М-циклин синтезируется во
время G2 и М-фаз. Накопление циклина ведет к накоплению M-Cdk.
Cdk ингибируется, фосфорилируясь протеинкиназой Wee1. Активация
Cdc25 в поздней G2 дефосфорилирует M-Cdk, так же происходит
репрессия Wee1. Две протеинкиназы фосфорилируют Cdc25 – Polo
kinase и M-Cdk. M-Cdk так же фосфорилирует и ингибирует Wee1.
Способность M-Cdk активировать свой собственный активатор
(Cdc25) и ингибировать свой собственный ингибитор (Wee1) предполагает,
что активация M-Cdk в митозе резко усиливается при наличии
такой позитивной обратной связи. Малое количество активированных
Cdc25 активируют M-Cdk, которые активирует еще больше Cdc25
и супрессируют Wee1. Это приводит к большей дефосфориляции
M-Cdk и активации и тд. Такой механизм обеспечивает полную
активацию всех M-Cdk
Фосфорилирование ламинов M-Cdk приводит к их деградации. М-Cdk
фосфорилирует несколько субъединиц конденсинов, запуская конденсацию
хромосом.
M-Cdk фосфорилирует различные белки, запуская реорганизацию
микротрубочек и другие события ведущие к организации веретена
деления.
Циклин-зависимые
киназы
| вид | название | синоним | размер | функция |
| S.cerevisiae | Cdk1 | Cdc28 | 298 | все стадии клеточного цикла |
| S.pombe | Cdk1 | Cdc2 | 297 | все стадии клеточного цикла |
| D.melanogaster |
Cdk1 |
Cdc2 Cdc2c Cdk4/6 |
297 314 317 |
M G1/S, S, возможно М G1 обеспечивает рост |
| X.laevis | Cdk1 Cdk2 |
Cdc2 |
301 297 |
M S, возможно S |
| H.sapiens | Cdk1 Cdk2 Cdk4 Cdk6 |
Cdc2 |
297 298 303 326 |
M G1/S, S, возможно М G1 G1 |
В животных клетках имеются, по крайней мере, 7 различных
Cdk. Cdk1,2,4,6 напрямую участвуют в регуляции клеточного
цикла, тогда как остальные фосфорилируют другие Cdk и называются
Cdk-активирующие киназы (CAK).
Cdk7,8,9 являются регуляторами РНК полимеразы II. Cdk5 участвует
в дифференцировке нервных клеток.
У дрожжей Sc и Sp все события клеточного цикла контролируются
одной Cdk1. У многоклеточных организмов события контролируются
Cdk1 и Cdk2. Также у высших эукариот имеются Cdk4 и Cdk6
которые регулируют клеточный цикл в ответ на внеклеточные
сигналы.
Cdk фосфорилируют сотни различных белков по сериновым (S)
или треониновым (T) аминокислотным остаткам. Cdk узнает
мотиф другого белка по которому необходимо фосфорилировать:
[S/T*]PX[K/R], где S/T*- место фосфорилирования, X – любая
аминокислота, K/R-основные аминокислоты лизин (K) или аргинин
(R).
В отсутствии циклина активный центр Cdk заблокирован.
Cdk состоит из нескольких доменов: Т-петля (инактивирующая
петля) – закрывает активный центр в отсутствии циклина.
L12 helix, PSTAIRE helix.
Циклины
| Вид | G1 | G1/S | S | M |
| S.cerevisiae | Cln3 (Cdk1) |
Cln1,2 (Cdk1) |
Clb5,6 (Cdk1) |
Clb1,2,3,4 (Cdk1) |
| S.pombe | Puc1? (Cdk1) |
Puc1 Cig1?, (Cdk1) |
Cig2, Cig1? (Cdk1) |
Cdc13 (Cdk1) |
| D.melanogaster | cyclin D (Cdk4) |
cyclin E (Cdk2) |
cyclin E, A (Cdk2,1) |
cyclin A, B, B3 (Cdk1) |
| X.laevis | cyclin E (Cdk2) |
cyclin E, A (Cdk2,1) |
cyclin A, B (Cdk1) |
|
| H.sapiens | cyclin D1,2,3 (Cdk4,6) |
cyclin E (Cdk2) |
cyclin A (Cdk2,1) |
cyclin B (Cdk1) |
Циклины - цитоплазматические белки. Разрушение циклинов
происходит в протеосомах (см. обзор Протеасомы). Циклин
B – белок киназный домен, регуляторная субъединица. Начинает
синтезироваться в G1, достигает max в S и ранней профазе
и быстро разрушается в начале анафазы М. Когда концентрация
регуляторной субъединицы возрастает – активируется киназный
домен. Фосфорилирование специфических белков приводит к
компактизации х-м, разрушению ядерной об-ки и сборке веретена.
Циклин разрушается в протеасомах. Сигнальная послед-ть из
8-10 а-кт –блок разрушения - узнается распознающим белком,
убиквитинлигаза присоединиет убиквитин (76а-кт) к остаткам
лизина, который полиUb и узнается РНК-белковым комплексом
протеасомой. Фосфатаза переводит распознающий белок в неактивное
состояние, а циклин фосфорилирует переводя в активное ?чем
больше циклина, тем быстрее он разрушается.
Циклин фосфорилирует сериновые и треониновые остатки ламинов
вызывая их деполимеризацию, фосфорилирует гистон H1, участвует
в фосфорилировании блокирующим везикулярный транспорт –
разрушение ЭПР и АГ, фосфорилирует участок легкой цепи миозина,
ингибируя АТФ-азную активность и связывание с F-актином
– блокировка цитокинеза в раннем митозе. После разрушения
циклина белки дефосфорилируются.
Циклины – активаторы Cdk. Циклины, так же как и Cdk вовлечены
в различные, помимо контроля клеточного цикла, процессы.
Циклины разделяются на 4 класса в зависимости от времени
действия в клеточном цикле: G1/S, S, M и G1 циклины.
G1/S циклины (Cln1 и Cln2 у S. cerevisiae, циклин E у позвоночных)
достигает максимальной концентрации в поздней G1-фазе и
падает в S-фазе.
G1/S cyclin–Cdk комплекс запускает начало репликации ДНК
выключая различные системы подавляющие S-phase Cdk в G1-фазе
G1/S циклины также инициируют дупликацию центросом у позвоночных,
образование веретенного тела у дрожжей. Падение уровня G1/S
сопровождается увеличением концентрации S циклинов (Clb5,
Clb6 у Sc и циклин A у позвоночных), который образует S
циклин-Cdk комплекс который напрямую стимулирует ДНК репликацию.
Уровень S циклина остается высоким в течении всей S, G2-фаз
и начала митоза, где помогает началу митозу в некоторых
клетках.
М-циклины (Clb1,2,3 и 4 у Sc, циклин B у позвоночных) появляется
последним. Его концентрация увеличивается, когда клетка
переходит к митозу и достигает максимума в метафазе. М-циклин-Cdk-комплекс
включает сборку веретена деления и выравнивание сестринских
хроматид. Его разрушение в анафазе приводит к выходу из
митоза и цитокиезу.
G1 циклины (Cln3 у Sc и циклин D у позвоночных) помогает
координировать клеточный рост с входом в новый клеточный
цикл. Они необычны, так как их концентрация не меняется
от фазы клеточного цикла, а меняется в ответ на внешние
регуляторные сигналы роста.
APC комплекс (Anaphase-Promoting Complex)
Убиквитин лигаза митоза - APC состоит из 12 субъединиц и регулирует
различные процессы митоза, такие как разделение сестринских
хроматид (запускает разрушение когезинов), переход к анафазе,
анафазное расхождение хромосом, выход из митоза, разрешение
S-фазы. ARC разрушает митотический циклин B.
Имеются различные белки регулирующие активность ARC комплекса,
такие как Mps1, Bub1, Bub3, BubR1, Mad1 и Mad2. Они ингибируют
ARC комплекс, что ведет к остановке клеточного цикла в метафазе
митоза.
Ингибиторы комплексов циклин-Cdk
| Вид | Название | Синонимы | Гомологи | Цели, функции |
| S. cerevisiae | Sic1 Far1 |
Rum1 нет |
ингибирует S- и M-Cdk, подавляет активность Cdk в G1 ингибирует G1/S–Cdk в ответ на феромоны |
|
| S. pombe | Rum1 | Sic1 | ингибирует S– и М–Cdks, подавляет активность Cdk в G1 |
|
| D. melanogaster | Roughex/Rux Dacapo/Dap |
нет Cip/Kip |
ингибирует S– и M–Cdk, подавляет активность Cdk in G1 ингибирует G1/S–Cdks, подавляет активность Cdk в G1 |
|
| X. laevis | Xic1 | Kix1 | Cip/Kip | ингибирует G1/S– и S–Cdk |
| H. sapiens | p21 p27 p57 p15INK4b p16INK4a p18INK4c p19INK4d |
Cip1/Waf1 Kip1 Kip2 - - - - |
Cip/Kip Cip/Kip i Cip/Kip INK4 INK4 INK4 INK4 |
ингибирует G1/S– и S–Cdk, активирует cyclin D–Cdk4 ингибирует G1/S– и S–Cdks, активирует cyclin D–Cdk4 ингибирует G1/S– и S–Cdks, активирует cyclin D–Cdk4 ингибирует Cdk4, Cdk6 ингибирует Cdk4, Cdk6 ингибирует Cdk4, Cdk6 ингибирует Cdk4, Cdk6 |
Помимо циклинов имеются и другие регуляторы, такие как
p27, p53, анафазный ингибитор, Cdc20, polo-like киназа,
aurora киназа, Nek2 киназа и кинезинзависимые моторные белки.
p53 (опухолевый супрессор) - нестабильный
белок, узнает поврежденную ДНК, стабилизируется, накапливается
и стимулирует синтез ингибитора Cdk2. Нарушения в работе
p53 приводят к развитию раковых заболеваний.
p21 семейство - белки содержащие гомологичные
N-концевые участки, взаимодействующие с Cdk-циклинами. Активируются
в стареющих клетках. Образование индуцируется опухолевым
супрессором p53. Может блокировать субъединицы ДНК-полимеразы
p27 - межклеточные контакты стимулируют
его синтез - контактное подавление клеточного роста – задержка
в G0. Когда фибробласты помещаются в чашку они
начинают делиться пока монослой не покроет чашку – контактное
торможение. В опытах показано что существенную роль играют
не контакты, а степень распластывания – чем меньше распластана
клетка, тем больше времени занимает клеточный цикл. Округление
клеток сопровождается снижением общей интенсивности белкового
синтеза.
p57
p15, p16 семейство: взаимодействуют
с Cdk4 и Cdk6. Нарушают связь с циклинами D. Вероятно, задерживают
рост клеток.
Сокращения:
cdc-гены (cell-division-cycle genes) - гены клеточного цикла.
Мейоз
Основные события мейоза
Продолжительность мейоза
Премейотическая интерфаза
Профаза I
Лептотена
Зиготена
Пахитена
Диплотена
Диакинез
Метафаза I
Анафаза
Телофаза
Интеркинез
Второе деление мейоза
Гаметогенез
Основные события мейоза
Мейоз – тип митоза, или редукционное деление, при котором из одной клетки образуется четыре, каждая из которых имеет вдвое меньше хромосом чем исходная; т.е. число хромосом уменьшается с диплоидного (2n) до гаплоидного (n). Мейоз происходит при образовании гамет - гаметный, при образовании спор - споровый и мейоз может быть зиготным. Смысл гаметного мейоза сводится к образованию половых клеток, при слиянии которых, восстанавливается число хромосом (до диплоидного) характерное для соматических клеток данного вида. Споровый тип мейоза происходит у растений для которых характерно чередование поколений - гаплоидного, размножающегося бесполым путем и диплоидного, размножающегося половым путем (см. обзор Размножение).
рис.1 Принципиальная схема мейоза. В соматических диплоидных клетках содержат две гомологичные хромосомы, одна отцовская и одна материнская. Они удваиваются в S-фазе клеточного цикла, образуя две пары сестринских хроматид. Хромосомы сближаются и между ними происходит кроссинговер - обмен участками между материнской и отцовской парами хроматид с образованием хроматид содержащих отцовские и материнские гены. Хромосомы конденсируются, выстраиваются и расходятся. Затем происходит второе деление мейоза.Стадии мейоза 2n-->S-->4n-->2x2n-->4x1n
Мультипликация, демонстрирующая основные события мейоза: meiosis.mpg [2,65 Mb]
Мейоз разделяют на ряд стадий, которые можно различить в световой микроскоп.
Первое деление мейоза
Профаза I мейоза разделяетя на ряд стадий.
лептотена (стадия тонких нитей) начинается спирализация х-м
зиготена (стадия сливающихся нитей),сближение и начало конъюгации гомологичных х-м, кот объединяются в бивалент
пахитена (стадия толстых нитей) м-у гомологичными х-мами осуществляется кроссинговер
диплотена (стадия двойных нитей) отталкивание гомологичных х-м, кот отделяются др от др в области центромер, но остаются связанными в областях прошедшего кроссинговера – хиазмах
диакинез (стадия обособления двойных нитей) гомологичные х-мы удерживаются в месте лишь в отдельных точках хиазм – уменьшение числа хиазм, компактность бивалентов
Метафаза I - завершается формирование веретена деления, его нити прикрепляются к центромерам хромосом, в результате чего биваленты устанавливаются в плоскости экватора веретена деления, образуя экваториальную пластинку.
Анафаза I - связи в бивалентах ослабляются и гомологичные хромосомы отходят друг от друга, направляясь к противоположным полюсам веретена деления. К каждому полюсу подходит гаплоидный набор хромосом, состоящий из двух хроматид.
Телофаза I - у полюсов веретена деления собирается одинарный гаплоидный набор хромосом, каждая из них содержит удвоенное количество ДНК (n2c).
Интеркинез - временной промежуток между первым и вторым делениями мейоза. Не всегда обязателен.
Второе мейотическое отделение (эквационное) протекает как митоз, только клетки, вступающие в него, несут гаплоидный набор хромосом.
ПРОДОЛЖИТЕЛЬНОСТЬ МЕЙОЗА
Продолжительность мейоза напрямую зависит от количества ДНК в ядре. Также продолжительность мейоза зависит от структуры хромосомной организации и особенностей данного вида.
| Вид | 2n | Время, ч | ДНК на клетку (пг) |
| Antirrhinum majus | 16 | 24.0 | 5.5 |
| Haploppapus gracilis | 4 | 36.0 | 5.5 |
| Secale cereale | 14 | 51.2 | 28.7 |
| Allium cepa | 16 | 96.0 | 54.0 |
| Tradescantia paludosa | 12 | 126.0 | 59.0 |
| Tulbaghia violacea | 12 | 130.0 | 58.5 |
| Lilium henryi | 24 | 170.0 | 100.0 |
| Lilium longiflorum | 24 | 192.0 | 106.0 |
| Trillium erectum | 10 | 274.0 | 120.0 |
ПРЕМЕЙОТИЧЕСКАЯ ИНТЕРФАЗА
ПРОФАЗА I
Лептотена
(стадия тонких нитей) начинается спирализация х-м
Зиготена
Происходит начало синапсисиса - спаривание гомологичных хромосмом с образованием бивалента, или синаптонемального комплекса, в котором хромосомы выровнены и соединены.
Во время зиготены образуется zDNA составляющая 0,3, 0,4% от всей ДНК. zDNA GC-обогащена и находится в блоках длиной 104 пн разбросанных вдоль хромосом. Добавление ингибиторов синтеза ДНК в зиготене, предотвращают синапсис.
Пахитена
Хромосомы конденсируются
Синаптонемальный комплекс
Мейоз проходит и в отсутствии синаптонемального комплекса, но без рекомбинации.
Диплотена
Диакинез
МЕТАФАЗА I
АНАФАЗА I
ТЕЛОФАЗА I
ИНТЕРКИНЕЗ
ПРОФАЗА II
МЕТАФАЗА II
АНАФАЗА II
ТЕЛОФАЗА II
ГАМЕТОГЕНЕЗ
СИНАПСИС
КРОССИНГОВЕР
Alberts, 2003
Alberts, 2003
Alberts,2003
Митоз
2n-->S-->4n-->2x2n
ПРОФАЗА.
В профазе происходят следующие события: конденсация хромосом, формирование веретена деления, распад ядрышек, эндоплазматического ретикулума (ЭР), цитоплазматических микротрубочек, снижается и прекращается синтез РНК.
Каждая хромосома двойная (2x2n), они тесно соприкасаются и спирализуются одна относительно другой.
Конденсация хроматина.
После S-фазы сестринские хроматиды остаются связаны мультибелковым комплексом когезинов располагающимся вдоль хроматид в процессе их удвоения. Когезины удерживают хроматиды вместе вплоть до их расхождения в анафазе.
Первый признак Митоза – конденсация хромосом (у человека в 50 раз). Конденсины – белки участвующие в конденсации. Запуск M-Cdk фосфорилирования конденсинов отвечает за их сборку в комплексы на ДНК и конденсации хромосом. При конденсации затрачивается энергия АТФ. Хромосомы конденсируются вокруг продольной центральной оси хромосомы на которой наблюдается наибольшая концентрация конденсинов. В фиксированных препаратах наблюдается сначала спиральная укладка конденсинов вдоль хромосомы (рис.1 )
рис.1 Спиральная укладка хроматид - окраска на специфические белки показывает их спиральное расположение в хромосомах.
Конденсины и когезины структурно родственны и работают по одинаковым механизмам. Установлено, что если после S-фазы соединение хроматид не наступило правильно, то конденсация также не наступает.
Конденсины (когезины) образуют димеры антипараллельно направленные на концах которых находятся ДНК- и АТФ-связывающие домены, а на середине гибкий шарнир (рис.2).
рис.2
Когезины связывают хромосомы еще в S-фазе.
Cohesin is a four-subunit protein complex, in which a heterodimer of SMC proteins, in this case SMC1/SMC3, associates with two other proteins, the Scc1/RAD21/Mcd1 and Scc3 proteins. In vertebrates there are two variants of Scc3, called SA1 and SA2.(Jessberger 2005)
SMC (The structural maintenance of chromosomes proteins) обнаружены в бактериях и археях. В отличии от эукариотических, представляют гомодимеры, кодируемые одним геном.
рис.3 Structure of cohesin and a possible mechanism by which it might hold sister chromatids together. (A) Smc1 (red) and Smc3 (blue) form intramolecular antiparallel coiled coils, which are organized by hinge or junction domains (triangles). Smc1/3 heterodimers are formed through heterotypic interactions between the Smc1 and Smc3 junction domains. The COOH terminus of Scc1 (green) binds to Smc1's ABC-like ATPase head, whereas its NH2 terminus binds to Smc3's head, creating a closed ring. Scc3 (yellow) binds to Scc1's COOH-terminal half and does not make any direct stable contact with the Smc1/3 heterodimer. Scc1's separase cleavage sites are marked by arrows. Cleavage at either site is sufficient to destroy cohesion. By analogy with bacterial SMC proteins, it is expected that ATP binds both the Smc1 and Smc3 heads, alters their conformation, and possibly brings them into close proximity. By altering Scc1's association with Smc heads, ATP binding and/or hydrolysis could have a role in opening and/or closing cohesin's ring. (B) Cohesin could hold sister DNA molecules together by trapping them both within the same ring. Cleavage of Scc1 by separase would open the ring, destroy coentrapment of sister DNAs, and cause dissociation of cohesin from chromatin. (C) Smc-containing complexes other than cohesin could also function via chromatid entrapment. Condensin, for example (black), could organize mitotic chromosomes by trapping supercoils. It and/or other related complexes could hold distant loci together (arrow) and thereby facilitate the function of long-range enhancers and silencers of transcription.
Образование веретена деления
В микротрубочках веретена ~10^8 молекул тубулина. Веретено нормально функционирует при разрушении центриолей лазером. Центром организации микротрубочек служит аморфное вещество центросомы.
Микротрубочки растут от центросом, белки диненины связывают перекрывающиеся микротрубочки, которые продолжают расти и расталкиваются кинезинами, при этом полюса расходятся. В это время микротрубочки с кинетохором не связываются.
Число микротрубочек прикрепленных к кинетохорам различно у разных видов – у некоторых грибов – 1микротрубочка, у человека - 20-40.
Остаточное тельце – фрагменты полюсных микротрубочек+плотный матрикс.
После начала митоза центросомы расходятся и каждая образует радиально симметричный центр организации микротрубочек (астра). Центросома расположена у ядра. Две астры двигаются к противоположным сторонам ядра для формирования двух полюсов веретена деления. Когда ядерная оболочка разрушается (прометафаза) веретено захватывает хромосомы. В клетках эмбрионов Xenopus центросома удваивается даже если ядро было передвинуто, или репликация ДНК подавлена. Центросомный цикл продолжается почти нормально: сначала 2, потом 4, 8 центросом и т.д. На ооцитах Xenopus было показано, что G1/S-Cdk (комплекс cyclin E и Cdk2) инициирует ДНК репликацию в S фазе также стимулирует удвоение центросомы, это предположительно объясняет почему удвоение центросом происходит в начале S-фазы
Рост веретена зависит от моторных белков принадлежащих к двум семействам – kinesin-related proteins движущиеся к ‘+’
концу и денеины, движущиеся к ‘–‘. Три типа микротрубочек наблюдаются в веретене – астральные, кинетохорные, перекрывающиеся-создают правильную структуру веретена. Микротрубочки растут от центросомы вперед ‘+’ концом. Три вида микротрубочек различаются поведением и наборами присоед белков.
Веретено начинает собираться в профазе. M-Cdk запускают фосфорилирование двух типов белков контролирующих динамику микротрубочек. Типы: моторные белки и microtubule-associated proteins (MAPs). Также имеются белки катастрофины.
В интерфазе микротрубочки отходят от одной центросомы и находятся в динамическом равновесии. Переключение ведущее к росту называется спасение, переключение к уменьшению микротрубочек – катастрофа. В профазе длинные интерфазные микротрубочки быстро преобразуются в множество коротких окружающих каждую центросому, которые начинают формировать веретено деления.
РАСПАД ЭР
ЭР распадается на мелкие вакуоли, лежащие по переферии клетки и Аппарата Гольджи (АГ), который теряет околоядерную локализацию, разделяется на отдельные диктиосомы разбросанные в цитоплазме.
ПРОМЕТАФАЗА
Распад ядерной оболочки, беспорядочное движение хромосом в области бывшего ядра, хромосомы через кинетохор соединяются с веретеном и начинают движение.
Распад ядерной оболочки
Кинетохор
Sc: кинетохор связан с цетромерным локусом CEN: CDEI,II,III. CDEI,III – консервативные районы сходны с Dm. CDEII – обогащен АТ, участок разной длины. CDE ответственен за связь с мт, взаимодействует с рядом белков.
кинетохор – мультибелковый комплекс, состоит из трех слоев:
наружный – плотный (СENP-E, СENP-F – участвуют в связывании мт), от него отходит множество фибрилл – фиброзная корона кинетохора (СENP-E, динеины)
средний – рыхлый, 3F3/2 – белок, регистрирует натяжение пучков мт
внутренний – плотный, участок ГХ обогащенный а-сателлитной ДНК (СENP-B- связывается с а-ДНК, MCAK-кинезинподобный белок-когезин, INCENP-когезин, СENP-А-аналог H3, СENP-G-связывается с белками ядерного матрикса, СENP-С-ф-ция не выяснена)
Функция кинетохора: связывание хроматид, закрепление мт веретена.
min число мт у Sc 1 на хромосому, у высших растений 20-40 мт на хромосому
белки кинетохора присутствуют во всех стадиях кц, образование и деление кх происх в S-периоде
Х-мы беспорядочно движутся – метакинез – то приближаются к полюсам, то удаляются к центру веретена, пока не займкт среднее положение – конгрессия х-м. мт случайно захватываются кинетохором и х-мы скользят по мт к полюсу 25мкм/мин, с помощью аналога динеина. Во время движения мт не разбираются. Хроматиды связаны и тянутся с двух сторон. Если лазером перерезать мт с одной стороны, то х-мы утянуться к противоположному полюсу
Перемещение хромосом к экватору
если митотич кл обработать D2O или таксолом – подавляют разборку мт?мт удлиняются и не тянут хромосомы?блок митоз
колхицин, низкая t, высокое гидростатич давление – разрушение нитей веретена?блок митоз
сила действующая на кинетохорную нить тем слабее чем ближе к полюсу нах кинетохор
МЕТАФАЗА
Завершается формирование веретена деления, хромосомы перестают двигаться и выстраиваются по экватору веретена (экваториальная пластинка)
метафаза - синтез белка – 20-30% от интерфазы. Клетки наиболее чувствительны к холоду, колхицину и др. агентам, которые разрушают веретено деления и приводят к прекращению митоза (К-митоз), при малых дозах митоз восстанавливается через несколько часов (иначе гибель либо полиплоидия).
Метафаза – хромосомы образуют пластинку, микротрубочки достигают max концентрации и перекрываются.
АНАФАЗА
Анафаза – хромосомы внезапно одновременно отделяются друг от друга и начинают движение к полюсам. Центромеры разъединяются – деградация центромерных когезинов. Наиболее короткая стадия, разделение хроматид и расхождение хромосом к полюсам (v=0,2-5 мкм/мин). Иногда также расходятся полюса друг от друга.
Расхождение хромосом за счет кинетохорных пучков микротрубочек – анафаза А, расхождение хромосом вместе с полюсами за счет удлинения межполюсных микротрубочек – анафаза В.
Разделение хроматид и движение к полюсам.
Веретено и перетяжка связаны так, что пока хромосомы не разойдутся перетяжка цитоплазмы не наступает.
События анафазы: движение кинетохорных нитей к полюсам, движение полюсных нитей расталкивающих полюсы-движутся друг относительно друга; малые дозы хлоралгидрата предотвращают удлинение и движение полюсных нитей, но не влияют на кинетохорную нить.
ТЕЛОФАЗА.
Телофаза длится с момента прекращения движения хромосом. Происходит реконструкция ядер - образование ядерной оболочки, деспирализация хромосом, активация хромосом - увеличение уровня транскрипции, формирование ядрышек, разрушение веретена деления, разделение клеток, образование остаточного тельца Флеминга, образование перетяжки.
В местах контактов хромосом с мембранными пузырьками начинает образовываться ядерная оболочка. Сначала она образуется на латеральных поверхностях хромосом, затем в центромерных и теломерных участках. После смыкания ядерной оболочки происходит образование ядрышек.
Разборка микротрубочек идет от полюсов к экватору бывшей клетки, в средней части веретена микротрубочки сохраняются дольше всего – остаточное тельце.
Цитокинез.
Борозда деления образуется в плоскости метафазной пластинки под прямым углом к длинной оси митотического веретена. Перетяжка содержит актиновые филаменты и миозин II, расположенные по экватору делящейся клетки под плазматической мембраной (ПМ) стягивая ее изнутри.
Одной из причин почему цитокинез не происходит раньше окончания митоза является активность M-Cdk инактивируемой в конце митоза.
ИНТЕРФАЗА.
Основные сведения
Лизосомы
Лизосомы
- клеточные органеллы образованные одним бислоем мембраны. В лизосомах происходит разрушение комплексов лиганд-рецептор
метаболизм холистерола
гидролазы разрушают белки, липиды, углеводы, нуклеиновые кислоты
Внутри лизосом поддерживается постоянный pH = 5, обеспечиваемый ATP-зависимой помпой, которая посредством антипорта Na
+
и H
+
закачивает H
+
внутрь лизосомы. pH поддерживается так же Cl-ионными каналами
Ферменты лизосом: рибонуклеаза, дезоксирибонуклеаза, фосфатаза, гликозидазы, арилсульфатазы (органические эфиры серной кислоты), коллагеназа, катепсины
Структура лизосомного фермента D катепсина с присоединенным сахаром включающим маннозу: PDB = 1LYA.
lgpA lgpB группа интегральных белков 100-120 кДа, сильно гликозилированы. Гликозилирование собственных мембранных белков предотвращает самопереваривание.
Белки лизосом синтезируются в ЭР, проходя транс-сеть АГ, образуют эндосомы которые сливаются
d=0,2-2мкм. деградация клеточных компонентов, ~40 гидролаз (нуклеазы, протеиназы, гликозидазы, липазы, фосфатазы, сульфатазы, фосфолипазы) с оптимумом pH~4,5-5 (в цитоплазме ~7-7,3) - протонные насосы - защита от деградации клетки
образуемые в ШЭР белки гликозилируются в АГ, терминальные маннозные остатки (Man) фосфорилируются по С-6, с образованием концевого остатка -
маннозо-6-фосфат
(Man-6-P). Рецепторы АГ узнают Man-6-P, происходит локальное накопление белков в АГ –
клатрин
– вырезает и транспортируют подходящие мембранные фрагменты в составе транспортных везикул к эндолизосомам. В эндолизосомах происходит понижение pH протонными насосами (H
+
-ATP-аза). Происходит диссоциация белков от рецепторов, отщепление фосфатной группы от Man-6-P. Man-6-P рецепторы используются вторично после рецикла – переносятся в АГ.
транс-Гольджи содержит
манноз 6-фосфатный рецептор связывающий фосфарилированную маннозу лизосомных ферментов,
направляя ферменты к транспортной везикуле.
Первичные лизосомы.
Аутофагия
– захват органеллы =
вторичные лизосомы
– процесс гидролитического расщепления |
остаточные тельца.
Гетероцитоз
– слияние лизосомы с эндосомами эндо- и фагоцитоза.
Мембранные элементы лизосом защищены от действия кислых гидролаз олигосахаридными участками, которые не узнаются ферментами, или мешают гидролазам взаимодействовать с ними.
оксидаза D-аминокислот
– окисляет D-аминокислоты до кетокислот.
Разрушение белков в лизосомах.
Цитоплазматические белки могут разрушаться в протеасомах (см. обзор
Протеасомы
) или в лизосомах. Разрушаемые белки имеют специфический участок узнаваемый шаперонами, которые связываясь с белком транспортируют его к рецепторам на мембране лизосомы. Белок расплетается шаперонами и проникает в канал, ведущий внутрь лизосомы, на другом конце которого протеаза разрезает белок на мелкие фрагменты. Активность такого пути заметно снижается в фибробластах и клетках печени старых крыс. Такое снижение способствует накоплению ненужных белков, нарушая различные клеточные процессы.
Автофагия
При длительном голодании клетка берет энергию и необходимые компаненты для своего выживания разрушая некоторые органеллы. В разрушении органелл участвуют лизосомы.
Органеллы образуемые из лизосом
В некоторых дифференцированных клетках лизосомы могут выполнять специфические функции, образуя дополнительные органеллы. Все
дополнительные функции связаны с секрецией веществ.
| органеллы | клетки | функции |
| меланосомы |
меланоциты, ретинальный пигментный эпителий |
образование, хранение и транспорт меланина |
| тромбоцитные гранулы | тромбоциты, мегакариоциты | освобождение АТФ, АДФ, серотонина и кальция необходимых для свертывания крови |
| ламеллярные тельца | эпителий легких типа II | хранение и секреция сурфактанта необходимого для работы легких |
| лизирующие гранулы |
цитотоксические Т лимфоциты, NK клетки |
разрушение клеток инфицированных вирусом или опухолевы |
| ГКГ класс II | антиген представленные клетки (дендритные клетки, В лимфоциты, макрофаги и др.) |
Изменение и представление антигенов для CD4+ T лимфоцитов для имунной регуляции |
| базофильные гранулы | базофилы, mast клетки | запускают высвобождение гистаминов и других воспалительных стимулов |
| азурофильные гранулы | нейтрофилы, эозинофилы | высвобождают микробицидные и воспалительные агенты |
| остеокластные гранулы | остеокласты | разрушение костей |
| тельца Вейбеля-Палладе | эндотелиальные клетки | созревание и регулируемый выброс фактора Виллебрандта в кровь |
| а-гранулы тромбоцитов | Тромбоциты, мегакариоциты | выброс фибриногена и фактора Виллебрандта для адгезии тромбоцитов и свертывания крови |
Заболевания связанные с лизосомами
Tay-Sachs disease
Pompe's disease
chediak-Higashi синдром
Hermansky-Pudlak синдром
Griscelli синдром
Некоторые паразиты способны проникать в клетки через лизосомы.
Сокращения.
ЭР - эндоплазматический ретикулум
АГ - аппарат Гольджи
Матрикс
Клетки многоклеточного организма способны синтезировать в межклеточную среду различные вещества формирующие межклеточный матрикс выполняющий различные функции:
1. Межклеточный матрикс может разделять две группы клеток, препятствуя контакту между ними.
2. По межклеточному матриксу может происходить миграция клеток.
3. Межклеточный матрикс способен индуцировать дифференцировку клеток. Эпителиальные клетки образовали плотный межклеточный слой - базальная пластинка, а мезенхимные клетки образовали рыхлую ретикулярную пластинку. Оба эти слоя составляют базальную мембрану пласта эпителиальных клеток.
В состав внеклеточного матрикса входят три основных компонента: коллаген, протеогликаны и гликопротеины.
Консистенция внеклеточного матрикса зависит от соотношения коллагена и протеогликанов. Хрящ характеризующийся высоким содержанием протеогликанов, мягок, тогда как связки с высоким содержанием коллагенов - жесткие.
В базальных пластинках преобладают протеогликаны образуя структурную опору и выполняют роль молекулярного сита.
Коллаген
Коллаген - семейство гликопротеинов, содержащих в большом количестве остатки глицина и пролина. Являясь главной структурной опорой почти любого органа животных, коллаген составляет ~ 1/2 - 1/4 массы всех белков организма.
Коллаген образует нерастворимые очень прочные фибриллы.
Коллагены кодируются более чем 10 генами:
| тип |
локализация
|
признаки и функция
|
| I | кожа, кость, сухожилия, роговица | низкое содержание углеводов. Толстые, плотно упакованные, с периодичностью 67 нм. Наиболее распространенный коллаген. Выдерживают большие натяжения. |
| II | хрящь, стекловидное тело | Высокое содержание углеводов. Периодичность фибрилл 67 нм, образующие упругий эластичный матрикс |
| III | кожа, кровеносные сосуды, внутр. органы | Высокое содержание углеводов. Трехспиральные с дисульфидными мостиками. Периодичность 67 нм, обеспечивают опору и эластичность. |
| IV | базальные мембраны | Образуют сети, служащие для прикрепления клеток, обеспечивают избирательную проницаемость. Связываются с ламинином. |
| V | перицеллюлярное пространство | Содержит большое колличество коллагена. Гибкие, с периодичностью 67 нм фибриллы. Функция не известна. |
| VI | кровеносные сосуды, почки, кожа, плацента, мышцы, печень | Микрофибриллы с периодичностью 105-110 нм; фибрилл нет. Заякоривают нервы и кровеносные сосуды в тканях. |
| VII | хориоамниотические оболочки | Длинные цепи коллагена. Участвует в заякоривании фибрилл. |
| VIII | эндотелиальные клетки, внеклеточный матрикс клеток нервного гребня | Три коллагеновых домена, связанные в виде тандема двумя неколлагеновыми доменами. Фибрилл нет. |
| IX | подразделения коллагена типа II хряща | Содержит три коллагеновых и четыре неколлагеновых домена и прикрепляет гликозаминогликаны. Функция не известна. Цепи короткие |
| X | гипертрофированный хрящ (зона роста) | Короткие цепи.Функция в минераллизации коллагенов |
| XI | хрящ | Три цепи. Функции не известны. |
| XII | хрящ | Функции не известны. |
| XIII | хрящ, кость, эпидермис, скелетная мускулатура | Функции не известны. |
Посттрансляционные модификации коллагена зависят от органа, ткани и возраста.
Типы I-IV: Gly-X-Y часто Gly-Pro-Hyp (Hyp-оксипролин, только в коллагене и эластине - котрансляционная модификация).
Pro перед Gly – гидроксилирование (4С) пролилгидроксилазой.
Лизингидроксилаза гидроксилирует -С Lis перед Gly =оксилизин -является точкой гликозилирования +галактоза +фруктоза =тропоколлаген (фибробласты) -3000А d=15А –тройная спираль полипептидов, идущих в одном направлении.
Gly позволяет трем цепям сблизиться – образ H-связи
проколлаген (140 кДа).
Протеогликаны
Протеогликаны - особый тип гликопротеинов у которых масса углеводных остатков значительно превосходит массу белка и углеводы представлены линеными цепями повторяющихся дисахаридов. Обычно один из сахаров дисахарида имеет аминогруппу, поэтому повторяющуюся единицу называют гликозаминогликаном.
Повторяющиеся единицы наиболее обычных гликозаминогликанов (ГАГ) в протеогликанах матрикса.
| ГАГ | Повторяющаяся дисахаридная единица | распространение |
| гиалуроновая кислота | гиалуроновая кислота-N-ацетилглюкозамин | соединительные ткани, кость, стекловидное тело. |
| хондроитинсульфат | глюкуроновая кислота-N-ацетилглюкозаминсульфат | хрящ, роговица, артерии |
| дерматансульфат | [глюкуроновая или идуроновая кислота] -N-ацетилгалактозаминсульфат |
кожа, сердце, кровеносные сосуды |
| кератансульфат | Галактоза-N-ацетилглюкозаминосульфат | хрящ, роговица |
| гепарансульфат | [глюкуроновая или идуроновая кислота] -N-ацетилгалактозаминсульфат |
легкое, артерии, клеточные поверхности |
Синдекан - белок М=33000 Да, несущий хондроитинсульфатные и гепарансульфатные гликозаминогликаны. Обнаружен в клеточной мембране и особенно выражен на базальной поверхности эпителиальных клеток в местах их контакта с азальной пластинкой. Заякоренный
в клеточной мембране, синдекан может прикрепляться к фибронектину и к коллагену разных типов. При ингибировании синтеза синдекана в эпителиальных клетках, то клетки утрачивают адгезивность к базальной пластинке и преобретают вид мезенхимных клеток. Если же синдекан трансформировать в фибробласты, то они конденсируются в плотные агрегаты. Синдекан синтезируется в мезенхимных клетках почки, зуба, зачатка конечности при развитии организма, когда происходит индукция конденсации клеток.
Одни и те же гликозаминогликаны в разных тканях могут выполнять различные функции. Гепарансульфатные гликозаминогликаны, например, являются универсальными компонентами базальной мембраны, но в нервной системе они стимулируют пролиферацию шванновских клеток. Аксоны ганглиев спинных корешков на некоторых белках клеточной поверхности содержат гепарансульфат; удаление этого протеогликана ингибирует пролиферацию окружающих шванновских клеток. В развивающейся почке конечности гепарансульфат (но
не хондроитинсульфат) способствует индукции хрящевого фенотипа и росту хрящевых узелков.
 Образование и строение гликозаминогликанов.
Образование и строение гликозаминогликанов.
 микрофотография гиалуронидата в водном растворе, демонстрирующая разветвленную фибриллярную сеть
микрофотография гиалуронидата в водном растворе, демонстрирующая разветвленную фибриллярную сеть
Гликопротеины
Эластин
Эластин формирует стенки эластичных тканей (артерии, легкие, связки)
Предшественник - тропоэластин (у фибробластов ~760 аа) | ? -Gly, Ala, ? - гидрофобные белки Val | гидрофильные участки обогащены Lis | при созревании тропоэластина Lis?аль-лизин лизиноксидаза-Cu2+? 4лизина агрегируют –десмозин –объединение 4цепей | сшивки делают эластин нер-римым белком, участки с конформ. неупорядочен. белка способны растягиваться | инактивация лизиноксидазы: дефицит-Cu2+, блок. пиридоксаля в акт. центре
ф-та –утрата эластичности-разрыв аорты.
Фибронектин
Гликопротеиновый димер М=460 кДа, синтезируемый фибробластами, хондроцитами, эндотелиальными клетками, макрофагами и некоторыми эпителиальными клетками, например, гипатоцитами и амниоцитами.
Фибронектин служит общей адгезивной молекулой, связывая клетки с различными субстратами (коллаген, протеогликаны).
Фибронектин участвует в миграции клеток при развитии.
Тетрапептид RGDS располагающийся на расстоянии 3/4 длины от N-конца фибронектина является сайтом связывания клеток с субстратом. Имеется так же "высокоафинный сайт" узнаваемый некоторыми клетками располагающийся в 300 аа от N-конца.Оба сайта необходимы для адгезии фибробластов к внеклеточноми матриксу.

Ламинин

Энтактин
Молекулы клеточной адгезии cell molecules,CAM – обеспеч кальций-независ межкл адгезию | стр-ра схожа с иммуноглобулинами-сод сходные домены | N-CAM нейрональные САМ: L1, нейроглиан, TAG-1, F11, нейрональная САМ, apCAM, фасциклинII, MAG, фасциклинIII – гомофильное связывание м-у N-САМ соседних кл обеспеч связывание кл; 20 родственных мол-л образ при альтернативном сплайсинге | I-CAM – класс белков, осущ межкл адгезию путем гетерофильного связывания с др белками пов-ти кл |
интегрины - семейство молекул клеточной адгезии обеспечивающих клеточные контакты с внеклеточным матриксом регулируя клеточную подвижность, полярность, рост и выживание. Присоединение лигандов приводит к кластеризации интегринов, присеодинении актиновых филаментов и сигнальных белков к цитоплазматическим доменам интегринов - образуются комплексы клеточной адгезии.
Интегрины - рецепторы клеток к фибронектину и ламинину
 Механизм взаимодействия мембраны клетки с межклеточным матриксом и цитоскелетом через трансмембранные интегриновые рецепторы.
Механизм взаимодействия мембраны клетки с межклеточным матриксом и цитоскелетом через трансмембранные интегриновые рецепторы.
Интегрины состоят из α- и β-субъединицы. Специфичность связывания интегрина зависит от комбинаций субъединиц и внеклеточного окружения. Имеется 11 α-субъединиц и 4 β-субъединиц фибронектина.
Митохондрии
 Митохондрия
МитохондрияРазмеры и форма митохондрий сильно варьирует у разных видов. Обычно ширина ~0,5 мкм, длина 7-60 мкм.
Митохондрии подвижные, пластичные, постоянно изменяют форму, могут ветвиться, сливаться друг с другом, и расходится. Перемещение митохондрий связано с микротрубочками.
В культуре клеток эндотелия сердца головастика ксенопуса наблюдали до 40 случаев слияния и деления митохондрий за 1 час.
Митохондрии расположены около мест высокого потребления АТФ (между миофибриллами в сердечной мышце, вокруг жгутика сперматозоида).
Число митохондрий зависит от потребности клетки в энергии, чем больше потребность, тем больше митохондрий в клетке и тем более они развиты.
Сложная форма митохондрий затрудняет их микроскопическое исследование. На срезе одна извитая митохондрия может быть представлена
несколькими сечениями (3-5), и только пространственная трехмерная реконструкция, построенная на изучении серийных срезов, может решить вопрос, имеем ли мы дело с 3-6 отдельными митохондриями или же с одной изогнутой или разветвленной.
В некоторых клетках имеется одна сильно разветвленная митохондрия (одноклеточные зеленые водоросли Polytomella, Engiena, Chlorella). Длинные ветвящиеся митохондрии были описаны в клетках культуры ткани млекопитающих, в клетках многих растений как в нормальных, так и в анаэробных условиях.
В последнее время стал широко применяться для изучения свойств митохондрий флуорохром родамин. Этот краситель обладает способностью люминисцировать в фиолетовом свете, если он связывается с мембранами активных митохондрий. При этом в люминисцентном микроскопе видна единая митохондриальнвя система – митохондриальный ретикулум.
Печеночную клетку приходится около 200 митохондрий. Это составляет более 20% от общего объема цитоплазмы и около 30-35% от общего
количества белка в клетке. Площадь поверхности всех митохондрий печеночной клетки в 4-5 раз больше поверхности ее плазматической мембраны. Больше всего митохондрий в ооцитах (около 300000) и у гигантской амебы Chaos chaos (до 500000).
В клетках зеленых растений число митохондрий меньше, чем в клетках животных, так как часть их функций могут выполнять хлоропласты. В спермиях часто присутствуют гигантские митохондрии, спирально закрученные вокруг осевой части жгутика.
Отсутствуют митохондрии у кишечных энтамеб, живущих в условиях анаэробиоза, и у некоторых других паразитических простейших.
Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТФ, образующейся в митохондриях. Так, в скелетных мышцах митохондрии находятся вблизи миофибрилл. В сперматозоидах митохондрии образуют спиральный футляр вокруг оси жгутика; вероятно, это связано с необходимостью использования АТФ для движения хвоста сперматозоида. Аналогичным образом
у простейших и в других клетках, снабженных ресничками, митохондрии локализуются непосредственно под клеточной мембраной у основания ресничек, для работы которых необходим АТФ. В аксонах нервных клеток митохондрии располагаются около синапсов, где происходит процесс передачи нервного импульса.
Строение митохондрий.
Внешняя мембрана
Внутренняя мембрана
Матрикс м-на, матрикс, кристы. она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Ее толщина около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии,
ее матрикс или митоплазму. Характерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист. Расстояние между мембранами в кристе составляет около 10-20 нм. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации. У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2-3 нм) и гранулы около 15-20нм. Теперь стало известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы – митохондриальные рибосомы.
Функции митохондрий
1. В митохондриях происходит синтез ATP (см. Окислительное фосфорилирование)
pH межмембранного пространства ~4, pH матрикса ~8 | содержание белков в м: 67% - матрикс, 21% -наруж м-на, 6% - внутр м-на и 6% - в межм-ном пр-ве
Хандриома – единая система митохондрий
наружная м-на: порины-поры позволяют проходить до 5 kD | внутренняя м-на: кардиолипин-делает непроницаемой м-ну для ионов |
межм-ное пр-во: группы ферментов фосфорилируют нуклеотиды и сахара нуклеотидов
внутренняя м-на:
матрикс: метаболические ферменты – окисление липидов, окисление углеводов, цикла трикарбоновых к-т, цикла Кребса
Происхождение от бактерий: амеба Pelomyxa palustris единств из эукариот не содержит м., живет в симбиозе с аэробными бактериями | собственная ДНК | схожие с бактериями оx процессы
Митохондриальная ДНК
Деление миохондрий
реплицируется
в интерфазе | репликация не связана с S-фазой | во время кл цикла митох один раз делятся надвое, образуя перетяжку, перетяжка сначала на внутр м-не | ~16,5 kb | кольцевая, кодирует 2 рРНК 22 тРНК и 13 белков |
транспорт белков: сигнальный пептид | амфифильный завиток | митохондриальный распознающий рецептор |
Окислительное фосфорилирование
Цепь переноса электронов
АТР-синтаза
в кл печени, м живут ~20 дней деление митохондрий путем образования перетяжки
16569пн=13белков,22тРНК,2pРНК | гладкая внешняя м-на (порины – проницаемость белков до 10 кДа) складчатая внутренняя (кристы) м-на (75% -белков: транспортные белки-переносчики, ф-ты, компаненты дыхат. цепи и АТФ-синтаза, кардиолипин) матрикс (обогащен ф-тами цитратного цикла) межм-ное пр-во
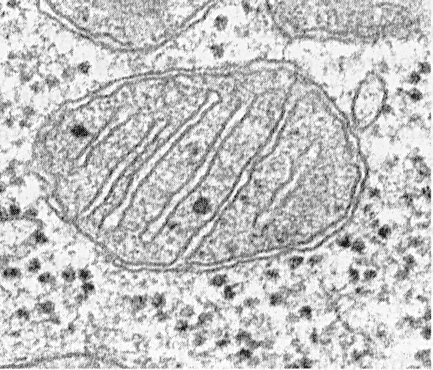
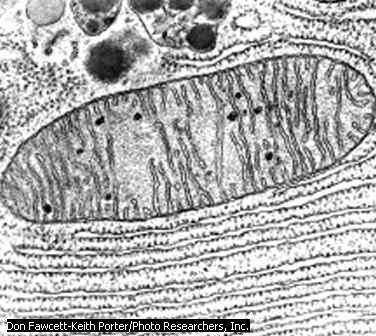
О клетках
В этом разделе вы узнаете о физических характеристиках клеток живых организмов
Размеры клеточных структур
Введение
Размеры клеток и клеточных структур
В обычной жизни мы не привыкли рассматривать объекты малых размеров, и представить и сопоставить относительные размеры клеток и субклеточных структур бывает довольно сложно. В таблице ниже представлены размеры различных клеток, органел, вирусов и биохимических молекул. В правом столбце таблицы представлены размеры, для того чтобы было удобно сравнивать между собой различные структуры в привычном нам масштабе. В таком увеличении 1 мкм будет равен 10 см, и довольно крупная эукариотическая клетка будет размером с ваш письменный стол, а все органеллы и молекулы можно легко сравнивать, если мысленно расположить их на этом столе.
| структура | размеры | визуализация |
| дрожжевая клетка | 5 мкм | 50 см |
| ооцит сельдевой акулы | 22 см (самая большая клетка) | |
| ооцит морского ежа | 100 мкм | 10 м |
| ооцит мыши | 50 мкм | 5 м |
| эукариотич. клетка | 15-20 мкм | 1.5x2 м |
| ПМ | 5-7 нм | 0,5-0,7 нм |
| ПМ с белками | 12,5-18,5 нм | 1,5 мм |
| актиновая нить | 5-9 нм | 0,5-0,9 мм |
| микротрубочка | 25 нм | 2,5 мм |
| промежуточный филамент | 10 нм | 1 мм |
| ядро | 10 мкм | 1м |
| ядерная пора | 15 нм (30 нм по снимку) | 1,5-3 мм |
| раст. м-у м-нами в ядре | 9 нм (60 нм по снимку) | 0,9-3 мм |
| яд. ламина (~ пром. фил.) | 30 нм | 3 мм |
| хлоропласт | 5-10x2-4 мкм | 20-40 см |
| жгутик d | 250 нм | 2,5 см |
| рибосомы | 20-(200?) нм | 2 мм |
| митохондрия | 1,6x0,8 мкм | 1,6x0,8 мкм |
| лизосомы | 0,2-2 мкм | 2-20 см |
| пероксисомы | 0,4-0,5 мкм | 4-5 см |
| центриоль | 500x200 нм | 5x2 см |
| ШЭР d | 20-50 нм | 2-5 мм |
| ГЭР цистерны | 50-100 нм | 5-10 мм |
| диски АГ (всего 3-12 шт) d | 0,2-0,5 мкм | 2-5 см |
| капли триглицеридов | 0,2-5 мкм | 2-50 см |
| гранулы гликогена | 10-40 нм | 1-4 мм |
| ДНК d | 2 нм | 0,2 мм |
| ДНК в нуклеосоме | 11 нм, 30 нм | 1,1-3 мм |
| интерфазная хромосома | Занимает все ядро | |
| митотическая хромосома | 2x5 мкм | 20x50см |
| полная длина ДНК (чел) | 1.088.000 мкм (1 м) | 108800 м |
| длина в нуклеосоме | 11нм, 30нм; x6, x40; | 18000, 2720 м |
| длина в 22 хромосоме | 1632 м | |
| длина в 22 х. в нуклеосоме | 40, 8 м | |
| коллаген фибрилла | 50 нм | 5 мм |
| коллаген-1 тройная спираль | 1,5 нм | 0,15 мм |
| белки | 2-10 нм (средн ~5 нм) | 0,2-1 мм |
| E.coli | 1x3 мкм | 10x30 см |
| клеточн стенка E.coli | 18-19 нм | 1,8-1,9 мм |
| Mycoplasma (самая мал кл) | 0.33 мкм | 33 мм |
| флагеллин – жгутик бакт. | 10-20 нм | 1-2 мм |
| poliovirus | 45 нм | 4,5 мм |
| SV40 | 70 нм | 7 мм |
| ВТМ | 20x200 нм | 2x20 мм |
| сахара, акты, нуклеотиды | 0,5-1 нм | 0,1 мм |
Ограничение размеров клетки
1. Необходимое для жизнедеятельности количество макромолекул
2. С увеличением объемов клетки скорости химических реакций ограничиваются скоростью диффузии молекул.
3. Оптимальное соотношение S/V. При увеличении размеров клеток объем возрастает гораздо быстрее, чем площадь поверхности, что приводит к резкому уменьшению числа молекул питательных веществ на единицу объема, проникших в клетку за единицу времени. Существование диффузионных ограничений объясняет, почему эукариотические клетки крупнее, чем прокариотические: цитоплазма эукариотических клеток разделена мембранами на компартменты в значительной мере для того, чтобы облегчить возможность быстрых взаимодействий между молекулами.
Растительные клетки крупнее животных, во-первых, из-за присутствия крупной центральной вакуоли, которая сама является довольно химически инертным компартментом, тогда как объем цитоплазмы растительной клетки относительно невелик, и, во-вторых, из-за осуществления циклоза - активного движения цитоплазмы, снижающего диффузионные ограничения.
Особые случаи большого размера клеток наблюдаются когда клетка не осуществляет активные химические превращения, а служит просто как резервуар для запасания и хранения веществ – яйцеклетки, клетки мякоти плодов.
Увеличение размеров клеток благодаря многократному повторению внутренних элементов клеточной структуры. Например, многоядерность увеличивает концентрацию молекул информационных РНК в цитоплазме и позволяет многоядерным клеткам быть крупнее одноядерных, поскольку снижает ограничения, связанные с диффузией РНК из ядра.
Повторения внутренних структурных элементов часто приводят к увеличению длины клеток при сохранении их микроскопического диаметра (например, у животных мышечные клетки длиной до нескольких см, нервные клетки с отростками длиной до 1 м, а у растений клетки флоэмы длиной до 5 мм).
Соотношение объемов клеточных структур (гепатоцит)
| Структура | % объёма | число |
|
цитозоль митохондрии цистерны ШЭР цистерны ГЭР ядро пероксисомы лизосомы |
54 22 9 6 6 1 1 |
1 1700 много много 1 400 300 |
| ПРОКАРИОТЫ | ЭУКАРИОТЫ | |
| размеры клеток | мелкие клетки | крупные клетки |
| форма | одноклеточные или нитчатые | одноклеточные, нитчатые или многоклеточные |
| ядро | нет ядра, нет ядрышка | имеется ядро и ядрышки |
| генетич материал | кольцевая ДНК, нет хромосом, нет гистонов | ДНК линейная, есть хромосомы, есть гистоны |
| синтез белка | 70S рибосомы | 80S рибосомы |
| органеллы | нет органелл с двойной м-ной | имеются хлоропласты, митохондрии, ядро |
| внутренние м-ны встречаются редко | АГ, лизосомы, вакуоли, микротельца, ЭПР | |
| клеточная стенка | жесткая клеточная стенка из полисахаридов и акт основной компонент – муреин |
у растений кл. стенка – целлюлоза у грибов кл. стенка - хитин |
| жгутики | жгутики простые из флагеллина, не окружены м-ной | сложные жгутики типа 9+2 окружены м-ной |
| дыхание | дыхание происходит в мезосомах | аэробное дыхание происходит в митохондриях |
| фотосинтез | хлоропластов нет, происходит в м-нах не имеющих специальной упаковки |
в хлоропластах, содержащих специальные м-ны уложенные в ламеллы и граны |
| фиксация азота | некоторые обладают такой способностью | ни один организм не способен |
к прокариотам относятся цианеи, актиномицеты, все бактерии, микоплазмы,
риккетсии и вирусы
Отличие животных, растений и грибов
| РАСТЕНИЯ | ЖИВОТНЫЕ | ГРИБЫ |
| автотрофное питание | гетеротрофное питание | |
| неподвижные | подвижные | |
| раздражимость гормонами и нервной системой | регуляция только гормонами | |
| рост в определенных участках - меристемах | рост всего тела | |
| высокое отношение V/S | низкое отношение V/S | |
| есть клеточная стенка | нет клеточной стенки | |
| нет центриолей | есть центриоли | |
| образ клеточная пластинка | образуется перетяжка | |
| постоянно существующие крупные вакуоли | мелкие непостоянные вакуоли | |
| имеются хлоропласты, содержащие хлорофилл | хлоропласты отсутствуют | |
| запасной полисахарид - крахмалл | запасной полисахарид – гликоген |
Список дифференцированных клеток человека
клеток в человеке ~1014.
Ороговевающие эпителиальные клетки
кератиноцит эпидермиса (= диф. эпидермальная клетка)
базальная клетка эпидермиса (стволовая)
кератиноцит ногтей
базальная клетка ногтевого ложа (стволовая)
клетки стержня волоса
клетка мозгового в-ва
клетка коркового в-ва
кутикулярная клетка
клетки корневого влагалища волоса
кутикулярная
слоя Гексли
слоя Генле
наружная
клетка волосяной матрицы (стволовая)
Клетка влажных многослойных барьерных эпителиев
поверхностная эпителиальная кл. многослойного чашуйчатого эпителия языка, ротовой полости, пищевода, анального отверстия, дистальной части уретры, влагалища
Базальная клетка тех же видов эпителия (стволовая)
Клетка наружного эпителия роговицы
Клетка эпителия мочевыводящих путей (выстилающего моч. пузырь и др.)
Эпителиальная клетка с экзокринной ф-цией
клетки слюнной железы
слизистая клетка (секрет богат полисахаридами)
белковая клетка (секрет богат гликопротеиновыми ф-тами)
клетки железы фон Эбнера в языке (сек-т для промывания вкусовых почек)
клетка молочной железы секретирующая молоко
к-ка слезной железы, секретирующая слезы
Клетки секретирующие гормоны
клетки передней доли гипофиза, выделяющие
гормон роста
фолликулостимулирующий гормон
лютеинизирующий гормон
адренокортикотропный гормон
тиреотропный гормон
к-ка промежуточной доли гипофиза, выделяющая меланоцитстимулир. г.
к-ки задней доли гипофиза, выделяющие
окситоцин
вазопрессин
клетки желудочно-кишечного тракта, секретирующие
серотонин
эндорфин
соматостатин
гастрин
секретин
холецистокинин
инсулин
глюкагон
клетки щитовидной железы, секретирующие
тиреоидный гормон
кальцитонин
клетки паращитовидной железы
секретирующие паратгормон
оксифильные клетки (ф-ция неизвестна)
клетки надпочечников, секретирующие
адреналин
норадреналин
стероидные гормоны
минералокортикоиды
глюкокортикоиды
клетки половых желез, секретирующие
тестостерон (клетки Лейдига в семенниках)
эстроген (клетки theca interna яйцевого фолликула в яичниках)
прогестерон (клетки желтого тела)
клетки юкстагломерулярного аппарата почки
юкстагломерулярные клетки (секретируют ренин)
клетки macula densa
периполярные клетки
мезангиальные клетки
Эпителиальные всасывающие клетки жкт, экзокринных желез и мочеполовых путей
клетка со щеточной каемкой из микроворсинок (в тонком кишечнике)
исчерченная клетка протока экзокринной железы
эпителиальная клетка желчного пузыря
клетка со щеточной каемкой в проксимальном почечном канальце
клетки дистального почечного канальца
безресничная клетка семевыносящего протока
клетки эпидермиса
главная клетка
базальная клетка
Клетки ответственные за процессы метаболизма и накопление резервных материалов
гепатоцит (печеночная клетка)
жировые клетки
клетка белого жира
клетка бурого жира
липоцит печени
Эпителиальные клетки, с барьерной ф-цией – выстилающие легкие, кишечник, экзокринные железы и мочеполовой тракт
пневмоциты типа I (выстилающие воздушную полость легкого)
клетка протока поджелудочной железы (центроацинарная клетка)неисчерченная к-ка протока потовой железы, слюнной , молочной ж. и др.
париетальная клетка почечного клубочка
подоцит почечного клубочка
клетка тонкой части петли Генле (в почках)
клетка собирательной трубочки (в почках)
клетки протока семенного пузырька, предстательной железы и т.д.
Эпителиальные клетки, выстилающие замкнутые внутренние полости
клетки эндотелия кровеносных и лимфотических сосудов
фенестрированная
непрерывная
селезеночная
синовиальные клетки (выстилающие суставные полости и секретирующие главным образом гиалуроновую к-ту
серозные клетки
чешуйчатые клетки, выстилающие перилимфотическое пр-во уха
клетки, выстилающие эндолимфотическое пр-во уха
чешуйчатая клетка
столбчатая клетка эндолимфотического мешочка
с микроворсинками
без микроворсинок
темная клетка
клетка вестибулярной м-ны (напоминает кл-ку сосудистого сплетения)
базальная клетка сосудистой полоски (stria vascularis)
маргинальная клетка сосудистой полоски
клетка Клаудиуса
клетка Бётчера
клетка сосудистого сплетения (сек-ющая цереброспинальную жидкость)
чешуйчатая клетка мягкой и паутинной об-к
клетки ресничного эпителия глаза
пигментированные
непигментированные
«эндотелиальная» клетка роговицы
Ресничные клетки
клетки дыхательных путей
клетки яйцевода и эндометрия (у женщин)
клетки (rete testis) и семевыносящего протока (у мужчин)
эпиндимальные клетки, выстилающие полости мозга
Клетки, секретирующие внеклеточное вещество эпителиальные
амелобласты (секретируют зубную эмаль)
клетки planum semilunatum
вестибулярного аппарата (сек-т протеогликан)
интердентальные клетки кортиева органа (сек-т в-во текториальной м-ны, лежащей над волосковыми клетками этого органа)
неэпителиальные (соединительнотканные)
фибробласты (рыхлой соединительной ткани, роговицы, сухожилий, ретикулярной ткани костного мозга)
перицит кровеносного капилляра
клетка nucleus pulposus межпозвоночного диска
цементобласт (цементоцит) (сектетирует цемент корня зуба)
одонтобласт (одонтоцит) (секретирует дентин зуба)
хондроциты
гиалинового хряща
волокнистого хрящаэластичного хрящаостеобласт (остеоцит)
первичная остеогенная клетка (стволовая клетка остеобластов)
гиалоцит стекловидного тела глаза
звездчатая клетка перилимфатического пространства уха
Сократимые клетки
клетки скелетных мышц
красные (медленные)
белые (быстрые)
промежуточные
мышечное
веретено с ядерной сумкой
мышечное веретено с ядерной цепочкой
клетки-сателлиты (стволовые клетки)
клетки сердечной мышцы
обычные
узловые (пейсмейкерные)
волокна Пуркинье
клетки гладких мышц (разные)
миоэпителиальные клетки
радужной оболочки
экзокринных желез
Клетки крови и иммунной системы
эритроцит
мегакариоцит
макрофаги
моноцит
макрофаги соединительной ткани (разные)
клетка Лангерганса (в эпидермисе)
остеокласт (в кости)
дендритная клетка (в лимфоидных тканях)
микроглиальная клетка (в цнс)
нейтрофил
эозинофил
базофил
тучная клетка
Т-лимфоциты
т-хелпер
т-супрессор
т-киллер
В-лимфоциты
IgM
IgG
IgA
IgE
клетка-киллер
стволовые клетки крови и иммунной системы (разные)
Сенсорные клетки
фоторецепторы
палочки
колбочки
чувствительные к синему
чувствительные к зеленому
чувствительные к красные
слуховые рецепторные клетки
внутренние волосковые клетки кортиева органа
наружные волосковые клетки кортиева органа
рецепторы ускорения и силы тяжести
волосковые клетки вестибулярного аппарата
тип I
тип II
вкусовые рецепторные клетки
клетки вкусовой луковицы, тип II
обонятельные рецепторные клетки
обонятельный нейрон
базальная клетка обонятельного эпителия (стволовая)
рецепторы pH крови
клетки каротидного тельца
тип I
тип II
осязательные рецепторные клетки
клетка Меркеля в эпидермисе
первичные осязательные нейроны (разные)
терморецепторные клетки
первичные терморецепторные нейроны
чувствительные к холоду
чувствительные к теплу
болевые рецепторы
первичные нейроны, чувствительные к боли (разные)
рецепторы положения
и напряжения в скелетно-мышечной сис-ме
первичные проприоцептивные нейроны (разные)
Вегетативные нейроны
холинэргические (разные)
адренэргические (разные)
пептидэргические (разные)
Опорные клетки органов чувств и периферических нейронов
Опорные клетки кортиева органа
внутренняя столбчатая клетка
наружная столбчатая клетка
внутренняя фаланговая клетка
наружная фаланговая клетка
пограничная клетка
клетка Генсена
опорная клетка вестибулярного аппарата
опорная клетка вкусовой почки (клетка вкусовой почки, тип I)
опорная клетка обонятельного эпителия
шванновская клетка
клетка сателлит (инкапсулирующая тела периферических нейронов)
глиальная клетка кишечника
Нейроны глиальных клеток
нейроны (много плохоклассифицированных типов)
глиальные клетки
астроциты (разные)
олигодендроцит
Клетка хрусталика
эпителиальная клетка передней части хрусталика
волокно хрусталика (клетка, содержащая кристаллины)
Пигментные клетки
меланоцит
эпителиальная кл-ка пигментного слоя сетчатки
Половые клетки
ооцит
сперматоцит
сперматогония (стволовая клетка сперматозоидов)
Питающие клетки
клетка овариального фолликула
клетка Сертоли (в семеннике), эпителиальная клетка тимуса
(Альбертс, 1994)
Пероксисомы
Пероксисомы содержат окислительные ферменты (каталаза, уратоксидаза, оксидаза-D-аминокислот) в высокой концентрации, так что на микрофотоснимках видны кристаллические структуры (см. рис 1). Наряду с митохондриями являются главным местом утилизации O2. Фермент пероксисом пероксидаза катализирует реакцию RH2+O2 = R+H2O2. Фермент каталаза катализирует реакцию H2O2+RH2 = R+2H2O, окисляя фенолы, муравьиную кислоту, формальдегид и спирты. При накоплении H2O2 происходит распад перекиси: H2O2 = 2H2O+O2
В пероксисомах происходит окисление жирных кислот, с образованием ацетил-CoA, который переходит в цитозоль для повторного использования в метаболических реакциях. У млекопитающих окисление жирных кислот происходит в митохондриях и пероксисомах, у дрожжей и растений - только в пероксисомах.
 Кристаллические включения в пероксисомах.
Кристаллические включения в пероксисомах.
Плазматическая мембрана
 рис.1
рис.1
Плазматическая мембрана. Виден липидный бислой. Светлая
область - внеклеточное пространство, темная - внутриклеточное
(Rees, 1996. P. 68).
Моделью строения плазматической мембраны
являестя жидкостно-мозаичная модель (рис.2), обладающая
свойствами замкнутости, текучести и асимметричности.
Замкнутость. Плазматическая мембрана является
внешней границей клетки, а также внутренних клеточных компартментов.
Текучесть. Липиды, белки и другие составляющие
плазматической мембраны движутся в пределах слоя. Переходы
между слоями называются flip-flop, происходят реже чем в
пределах слоя, что обеспечивает наличие свойства асимметричности.
Переходы между слоями осуществляют ферменты транслокаторы
фосфолипидов
Асимметричность. Внешняя и внутренняя поверхности
мембраны различаются по составу липидов белков и наием гликокаликса
на внешней поверхности мембраны.
 рис.2
рис.2
Жидкостно-мозаичная модель плазматической мембраны. Двойной
слой липидов, пронизанный различными белками. Наружная поверхность
белков соединена с сахарами, образующими гликокаликс. Липиды
состоят из гидрофобной части расположенной внутри бислоя
(оранж.) и гидрофильной наружной части (сер.). 
3D-модель липидного бислоя: membrane.rar
[450 Kb].
липидный бислой | мицелла, бислойная пленка-образования
амфипатических м-л в H2O | искусств бислои – сферические
везикулы - липосомы, черные м-ны – кажутся черными из-за
интерференции света белки:липиды=от1:4 в миелине до 3:1
в бактериях, липиды обеспеч электрич сопротивление, непрониц
для полярных соед и прониц для непол | м-ны способны образовывать
отверстия ч-з кот проходят малые мол-лы напр H2O | более
короткие цепи упакованы в менее жесткие стр-ры – уменьш
вязкости м-ны, удлинение ацильной цепи уменьшает текучесть
м-ны | двойные связи повышает текучесть м-ны | повышение
t повышает текучесть м-ны | поля (patch)– мол-лы с разными
св-вами могут объединяться в опред месте напр жесткая часть
пм прикрепляет кл к субстрату | вязкая м-на-более проницаема
для малых м-л (глюкоза)
мембраны имеют в среднем один белок на
25 липидов. Внутренняя мембрана митохондрий имеет 1 белок
не 15 липидов, мембрана миелина на 70 липидов.
Полупроницаемость мембран, что само проходит что с затратой
энергии (см обзор Транспорт)
 рис.3
рис.3
Микрофотография мембраны приготовленной методом замораживания-скалывания.
При этом мембрана раскалывается на две поверхности: P-поверхность
– гидрофобная часть внутреннего слоя мембраны, Е-поверхноть
– гидрофобная часть внешней половины бислоя.
На микрофотографии видны отверстия от интегральных белков,
оставшиеся при скалывании. Сами белки остались на другой
половине липидного бислоя. [Rees, 1996]
Компоненты мембран.
Мембраны газовых вакуолей некоторых бактерий
состоят из белков и имеют толщину 2 нм.
липиды 50 % m пм – фосфолипиды, холестерол, гликолипиды
– амфипатические м-лы – гидрофильная и гидрофобная часть
Длина гидрофобного хвоста 14-24 С (всегда четно) | цис-ненасыщ
образ изгиб предающий рыхлость м-не | коэф. диффузии липидной
м-лы D = 10-8 см2/с - ~2мкм/с | липиды вращ вокруг оси,
хвосты гибкие | в миелине ~1500 разных липидов |
ГЛИКОЛИПИДЫ - липиды,
содержащие олигосахарид. Располагаются только в наружной
мембране т.к. ферменты присоединяющие сахар находятся внутри
аппарата Гольджи. Гликокаликс - мукополисахаридный
наружный слой 3-10 нм в толщину, состаящий из остатков олигосахаридов,
имеет отрицательный заряд и составляет ~10% от массы мембраны.
Гликокаликс гидратирован, представляя собой желеподобную
структуру.
Галактоцереброзид-основной нейтральный гликолипид миелиновой
оболочки аксонов нервных клеток.
Ганглиозиды - гликолипиды с остатком сиаловой кислоты (GM1
- связывает холерный токсин).

ХОЛЕСТЕРОЛ придает механическую прочность
бислою, заполняя свободное пространство, большую текучесть,
способен свободно перетекать из слоя в слой, обеспечивая
изменение формы мембран при сжатии и растяжении. Холестерол
в некоторых мембранах может занимать до 25% по массе. Мембраны
прокариотических клеток не содержат холестерол.
ФОСФОЛИПИДЫ (фосфоглицериды)
– глицерол, две гидроксильные группы которого этерифицированы
жирными кислотами, третья фосфорной кислотой, этерифицированной
спиртом*. Составляют основу мембран. Состоят из гидрофильной
(фосфат со спиртом) и гидрофобной (неполярный хвост жирной
кислоты) частей. Так как содержимое клетки имеет водную
основу фосфолипиды ассоциируются в бислой, в котором гидрофобные
хвосты направлены друг к другу.
фосфатидилхолин - холиновая группа, *(CH3)3N+-CH2CH2OH
фосфатидилэтаноламин - *H2N-CH2CH2OH
фосфатидилсерин
кардиолипин – в значит кол-вах в м-нах бактерий
и во внутр м-не митох |
фосфатидилинозитол
cфингомиелин – отсутствует в мембране митохондрий.
фосфатидилглицерин - *глицерин. Является
главным фосфолипидом фотосинтетического аппарата всех растений.
Содержится также в мембранах сине-зеленых водорослей.
Фосфолипазы - ферменты разрушающие фосфолипиды
в различных местах, используются для анализа мембранных
липидов, некоторые получают из яда змей.
ИНТЕГРАЛЬНЫЕ БЕЛКИ.
Гликофорин А, содержащийся в мембранах эритроцитов, – первый
изученный интегральный белок. Содержит 24 аминокислоты в
а-спирали представляют собой трансмембранный домен:
arg+-val-gln-leu-ala-his-his-phe-ser-glu-pro-glu-ile-thr-leu-ile-ile-phe-gly-val-met-ala-gly-val-ile-gly-thr-ile-leu-leu-ile-ser-thr-gly-ile-arg+
Заряженные аминокислоты нейтрализуют друг друга His+ -Glu
Монотопные белки пересекают мембрану 1 раз, политопные белки
- несколько раз.
протеолипиды
протеогликаны
Периферические белки – (спектрин- на внутр м-не, фибронектин-на
внешней м-не) удерживаются ионными взаимод, соединены с
интегральными белками.
1. Монотопный белок, а-спиральный домен которого пронизывает
мембрану.
2. Политопный белок, пронизывающий мембрану несколько раз.
3. Белок присоединенный к мембране через жирную кислоту.
4. Белок
5. Периферические белки не имеют гидрофобных областей, а
содержат заряженные части взаимодействующие с другими белками
или фосфатными группами фосфолипидов.. [Альбертс, 1994.
T.2, P.360]
белки цитоскелета эритроцитов: полоса
1,2 спектрин (240-220кДа); п2.1,2.2-анкирины(200-210кДа);
п3-главный анионно-обменный белок (93кДа)-анионный канал,
обмен HCO3- на Cl- при выведении CO2; п4.1- белок связанный
с о спектрином и актином; п4.2-N-миристилиновый белок связан
с белком п3 и анкирином ; п4.9-актин-связывающий белок;
п5- актин (43кДа).
Детергенты (SDS, тритонX-100) разрушают мембраны клеток.
Внутренняя поверхность мембраны эритроцитов заряжена отрицательно
из-за содержания фосфатидилсерина.
Состав мембраны эритроцитов: гликолипиды-10%, холестерол-30%,
фосфолипиды-60%: фосфатидилхолин-28%, фосфатидилэтаноламин-27%,
сфингомиелин-26%, фосфатидилсерин-13%.
контактное торможение роста (density-dependent inhibition,
DDI) мутанты образуют опухоли.
Rees W.E. Life essay, 1996
Пластиды
 Хлоропласт
Хлоропласт
Пластиды – это мембранные органоиды, встречающиеся у фотосинтезирующих эукариотических организмов (высшие растения, низшие водоросли, некоторые одноклеточные организмы). Пластиды окружены двумя мембранами, в их матриксе имеется собственная геномная система, функции пластид связаны с энергообеспечением клетки, идущим на нужды фотосинтеза.
У высших растений найден целый набор различных пластид (хлоропласт, лейкопласт, амилопласт, хромопласт), представляющих собой ряд взаимных превращений одного вида пластиды в другой. Основной структурой, которая осуществляет фотосинтетические процессы, является хлоропласт.
У высших растений также встречается деление зрелых хлоропластов, но очень редко. Увеличение числа хлоропластов и образование других форм пластид (лейкопластов и хромопластов) следует рассматривать как путь превращения структур-предшественников, пропластид. Весь же процесс развития различных пластид можно представить в виде монотропного (идущего в одном направлении) ряда смены форм:
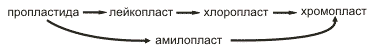
Многими исследованиями был установлен необратимый характер онтогенетических переходов пластид. У высших растений возникновение и развитие хлоропластов происходят через изменения пропластид. Пропластиды представляют собой мелкие (0,4-1 мкм) двумембранные пузырьки, не имеющие отличительных черт их внутреннего строения. Они отличаются от вакуолей цитоплазмы более плотным содержимым и наличием двух отграничивающих мембран, внешней и внутренней. Внутренняя мембрана может давать небольшие складки или образовывать мелкие вакуоли. Пропластиды чаще всего встречаются в делящихся тканях растений (клетки меристемы корня, листьев, в точки роста стеблей и др.). По всей вероятности, увеличение их числа происходит путем деления или почкования, отделения от тела пропластиды мелких двумембранных пузырьков.
Хлоропласты
 Хлоропласты – это структуры, в которых происходят фотосинтетические процессы, приводящие в конечном итоге к связыванию углекислоты, к выделению кислорода и синтезу сахаров. структуры удлиненной формы с шириной 2-4 мкм и протяженностью 5-10 мкм. У зеленых водорослей встречаются гигантские хлоропласты (хроматофоры), достигающие длины 50 мкм.
Хлоропласты – это структуры, в которых происходят фотосинтетические процессы, приводящие в конечном итоге к связыванию углекислоты, к выделению кислорода и синтезу сахаров. структуры удлиненной формы с шириной 2-4 мкм и протяженностью 5-10 мкм. У зеленых водорослей встречаются гигантские хлоропласты (хроматофоры), достигающие длины 50 мкм.
у зеленых водорослей может быть по одному хлоропласту на клетку. Обычно на клетку высших растений приходится в среднем 10-30 хлоропластов. Встречаются клетки с огромным количеством хлоропластов. Например, в гигантских клетках палисадной ткани махорки обнаружено около 1000 хлоропластов.
Хлоропласты представляют собой структуры, ограниченные двумя мембранами – внутренней и внешней. Внешняя мембрана, как и внутренняя, имеет толщину около 7 мкм, они отделены друг от друга межмембранным пространством около 20-30 нм. Внутренняя мембрана хлоропластов отделяет строму пластиды, аналогичную матриксу митохондрий. В строме зрелого хлоропласта высших растений видны два типа внутренних мембран. Это – мембраны, образующие плоские, протяженные ламеллы стромы, и мембраны тилакоидов, плоских дисковидных вакуолей или мешков.
Ламеллы стромы (толщиной около 20 мкм) представляют собой плоские полые мешки или же имеют вид сети из разветвленных и связанных друг с другом каналов, располагающихся в одной плоскости. Обычно ламеллы стромы внутри хлоропласта лежат параллельно друг другу и не образуют связей между собой.
Кроме мембран стромы в хлоропластах обнаруживаются мембранные тилакоиды. Это плоские замкнутые мембранные мешки, имеющие форму диска. Величина межмембранного пространства у них также около 20-30 нм. Такие тилакоиды образуют стопки наподобие столбика монет, называемые гранами.
Число тилакоидов на одну грану очень варьирует: от нескольких штук до 50 и более. Размер таких стопок может достигать 0,5 мкм, поэтому граны видны в некоторых объектах в световом микроскопе. Количество гран в хлоропластах высших растений может достигать 40-60. Тилакоиды в гране сближены друг с другом так, что внешние слои их мембран тесно соединяются; в месте соединения мембран тилакоидов образуется плотный слой толщиной около 2 нм. В состав граны кроме замкнутых камер тилакоидов обычно входят и участки ламелл, которые в местах контакта их мембран с мембранами тилакоидов тоже образуют плотные 2-нм слои. Ламеллы стромы, таким образом, как бы связывают между собой отдельные граны хлоропласта. Однако полости камер тилакоидов всезда замкнуты и не переходят в камеры межмембранного пространства ламелл стромы. Ламеллы стромы и мембраны тилакоидов образуются путем отделения от внутренней мембраны при начальных этапах развития пластид.
В матриксе (строме) хлоропластов обнаруживаются молекулы ДНК, рибосомы; там же происходит первичное отложение запасного полисахарида, крахмала, в виде крахмальных зерен.
Характерным для хлоропластов является наличие в них пигментов, хлорофиллов, которые и придают окраску зеленым растениям. При помощи хлорофилла зеленые растения поглощают энергию солнечного света и превращают ее в химическую.
Функции хлоропластов
Геном пластид
Подобно митохондриям, хлоропласты имеют собственную генетическую систему, обеспечивающую синтез ряда белков внутри самих пластид. В матриксе хлоропластов обнаруживаются ДНК, разные РНК и рибосомы. Оказалось, что ДНК хлоропластов резко отличается от ДНК ядра. Она представлена циклическими молекулами длиной до 40-60 мкм, имеющими молекулярный вес 0,8-1,3х108 дальтон. В одном хлоропласте может быть множество копий ДНК. Так, в индивидуальном хлоропласте кукурузы присутствует 20-40 копий молекул ДНК. Длительность цикла и скорость репликации ядерной и хлоропластной ДНК, как было показано на клетках зеленых водорослей, не совпадают. ДНК хлоропластов не состоит в комплексе с гистонами. Все эти характеристики ДНК хлоропластов близки к характеристикам ДНК прокариотических клеток. Более того, сходство ДНК хлоропластов и бактерий подкрепляется еще и тем, что основные регуляторные последовательности транскрипции (промоторы, терминаторы) у них одинаковы. На ДНК хлоропластов синтезируются все виды РНК (информационная, трансферная, рибосомная). ДНК хлоропластов кодирует рРНК, входящую в состав рибосом этих пластид, которые относятся к прокариотическому 70S типу (содержат 16S и 23S рРНК). Рибосомы хлоропластов чувствительны к антибиотику хлорамфениколу, подавляющему синтез белка у прокариотических клеток.
Так же как в случае хлоропластов мы вновь сталкиваемся с существованием особой системы синтеза белка, отличной от таковой в клетке.
Эти открытия вновь пробудили интерес к теории симбиотического происхождения хлоропластов. Идея о том, что хлоропласты возникли за счет объединения клеток-гетеротрофов с прокариотическими синезелеными водорослями, высказанная на рубеже XIX и XX вв. (А.С. Фоминцин, К.С.Мережковский) вновь находит свое подтверждение. В пользу этой теории говорит удивительное сходство в строении хлоропластов и синезеленых водорослей, сходство с основными их функциональными особенностями, и в первую очередь со способностью к фотосинтетическим процессам.
Известны многочисленные факты истинного эндосимбиоза синезеленых водорослей с клетками низших растений и простейших, где они функционируют и снабжают клетку-хозяина продуктами фотосинтеза. Оказалось, что выделенные хлоропласты могут также отбираться некоторыми клетками и использоваться ими как эндосимбионты. У многих беспозвоночных (коловратки, моллюски), питающихся высшими водорослями, которые они переваривают, интактные хлоропласты оказываются внутри клеток пищеварительных желез. Так, у некоторых растительноядных моллюсков в клетках найдены интактные хлоропласты с функционирующими фотосинтетическими системами, за активностью которых следили по включению С14О2.
Как оказалось, хлоропласты могут быть введены в цитоплазму клеток культуры фибробластов мыши путем пиноцитоза. Однако они не подвергались атаке гидролаз. Такие клетки, включившие зеленые хлоропласты, могли делиться в течение пяти генераций, а хлоропласты при этом оставались интактными и проводили фотосинтетические реакции. Были предприняты попытки культивировать хлоропласты в искусственных средах: хлоропласты могли фотосинтезировать, в них шел синтез РНК, они оставались интактными 100 ч, у них даже в течение 24 ч наблюдались деления. Но затем происходило падение активности хлоропластов, и они погибали.
Эти наблюдения и целый ряд биохимических работ показали, что те черты автономии, которыми обладают хлоропласты, еще недостаточны для длительного поддержания их функций и тем более для их воспроизведения.
В последнее время удалось полностью расшифровать всю последовательность нуклеотидов в составе циклической молекулы ДНК хлоропластов высших растений. Эта ДНК может кодировать до 120 генов, среди них: гены 4 рибосомных РНК, 20 рибосомных белков хлоропластов, гены некоторых субъединиц РНК-полимеразы хлоропластов, несколько белков I и II фотосистем, 9 из 12 субъединиц АТФ-синтетазы, части белков комплексов цепи переноса электронов, одной из субъединиц рибулозодифосфат-карбоксилазы (ключевой фермент связывания СО2), 30 молекул тРНК и еще 40 пока неизвестных белков. Интересно, что сходный набор генов в ДНК хлоропластов обнаружен у таких далеко отстоящих представителей высших растений как табак и печеночный мох.
Основная же масса белков хлоропластов контролируется ядерным геномом. Оказалось, что ряд важнейших белков, ферментов, а соответственно и метаболические процессы хлоропластов находятся под генетическим контролем ядра. Так, клеточное ядро контролирует отдельные этапы синтеза хлорофилла, каротиноидов, липидов, крахмала. Под ядерным контролем находятся многие энзимы темновой стадии фотосинтеза и другие ферменты, в том числе некоторые компоненты цепи транспорта электронов. Ядерные гены кодируют ДНК-полимеразу и аминоацил-тРНК-синтетазу хлоропластов. Под контролем ядерных генов находится большая часть рибосомных белков. Все эти данные заставляют говорить о хлоропластах, так же как и о митохондриях, как о структурах с ограниченной автономией.
Транспорт белков из цитоплазмы в пластиды происходит в принципе сходно с таковым у митохондрий. Здесь также в местах сближения внешней и внутренней мембран хлоропласта располагаются каналообразующие интегральные белки, которые узнают сигнальные последовательности хлоропластных белков, синтезированных в цитоплазме, и транспортируют их в матрикс-строму. Из стромы импортируемые белки согласно дополнительным сигнальным последовательностям могут включаться в мембраны пластиды (тилакоиды, ламеллы стромы, внешняя и внутренняя мембраны) или локализоваться в строме, входя в состав рибосом, ферментных комплексов цикла Кальвина и др.
Удивительное сходство структуры и энергетических процессов у бактерий и митохондрий, с одной стороны, и у синезеленых водорослей и хлоропластов – с другой, служит веским аргументом в пользу теории симбиотического происхождения этих органелл. Согласно этой теории, возникновение эукариотической клетки прошло через несколько этапов симбиоза с другими клетками. На первой стадии клетки типа анаэробных гетеротрофных бактерий включили в себя аэробные бактерии, превратившиеся в митохондрии. Параллельно этому в клетке-хозяине прокариотический генофор формируется в обособленное от цитоплазмы ядро. Так могли возникнуть гетеротрофные эукариотические клетки. Повторные эндосимбиотические взаимоотношения между первичными эукариотическими клетками и синезелеными водорослями привели к появлению в них структур типа хлоропластов, позволяющих клеткам осуществлять автосинтетические процессы и не зависеть от наличия органических субстратов (рис. 236). В процессе становления такой составной живой системы часть генетической информации митохондрий и пластид могла изменяться, перенестись в ядро. Так, например две трети из 60 рибосомных белков хлоропластов кодируется в ядре и синтезируются в цитоплазме, а потом встраивается в рибосомы хлоропластов, имеющие все свойства прокариотических рибосом. Такое перемещение большой части прокариотических генов в ядро привело к тому, что эти клеточные органеллы, сохранив часть былой автономии, попали под контроль клеточного ядра, определяющего в большей степени все главные клеточные функции.
Пропластиды
При нормальном освещении пропластиды превращаются в хлоропласты. Сначала они растут, при этом происходит образование продольно расположенных мембранных складок от внутренней мембраны. Одни из них простираются по всей длине пластиды и формируют ламеллы стромы; другие образуют ламеллы тилакоидов, которые выстраиваются в виде стопки и образуют граны зрелых хлоропластов. Несколько иначе развитие пластид происходит в темноте. У этиолированных проростков происходит в начале увеличение объема пластид, этиопластов, но система внутренних мембран не строит ламеллярные структуры, а образует массу мелких пузырьков, которые скапливаютсяя в отдельные зоны и даже могут формировать сложные решетчатые структуры (проламеллярные тела). В мембранах этиопластов содержится протохлорофилл, предшественник хлорофилла желтого цвета. Под действие света из этиопластов образуются хлоропласты, протохлорофилл превращается в хлорофилл, происходит синтез новых мембран, фотосинтетических ферментов и компонентов цепи переноса электронов.
При освещении клеток мембранные пузырьки и трубочки быстро реорганизуются, из них развивается полная система ламелл и тилакоидов, характерная для нормального хлоропласта.
Лейкопласты отличаются от хлоропластов отсутствием развитой ламеллярной системы (рис. 226 б). Встречаются они в клетках запасающих тканей. Из-за их неопределенной морфологии лейкопласты трудно отличить от пропластид, а иногда и от митохондрий. Они, как и пропластиды, бедны ламеллами, но тем не менее способны к образованию под влиянием света нормальных тилакоидных структур и к приобретению зеленой окраски. В темноте лейкопласты могут накапливать в проламеллярных телах различные запасные вещества, а в строме лейкопластов откладываются зерна вторичного крахмала. Если в хлоропластах происходит отложение так называемого транзиторного крахмала, который присутствует здесь лишь во время ассимиляции СО2, то в лейкопластах может происходить истинное запасание крахмала. В некоторых тканях (эндосперм злаков, корневища и клубни) накопление крахмала в лейкопластах приводит к образованию амилопластов, сплошь заполненных гранулами запасного крахмала, расположенных в строме пластиды (рис. 226в).
Другой формой пластид у высших растений является хромопласт, окрашивающийся обычно в желтый свет в результате накопления в нем каротиноидов (рис. 226г). Хромопласты образуются из хлоропластов и значительно реже их лейкопластов (например, в корне моркови). Процесс обесцвечивания и изменения хлоропластов легко наблюдать при развитии лепестков или при созревании плодов. При этом в пластидах могут накапливаться окрашенные в желтый цвет капельки (глобулы) или в них появляются тела в форме кристаллов. Эти процессы сопряжены с постепенным уменьшением числа мембран в пластиде, с исчезновением хлорофилла и крахмала. Процесс образования окрашенных глобул объясняется тем, что при разрушении ламелл хлоропластов выделяются липидные капли, в которых хорошо растворяются различные пигменты (например, каротиноиды). Таким образом, хромопласты представляют собой дегенерирующие формы пластид, подвернутые липофанерозу – распаду липопротедных комплексов.
Протеасомы
Стабильность белков и время их жизни является важным параметром в различных клеточных процессах и зависит от многих факторов, таких как наличие специфических последовательностей (например, сайт разрушения циклинов), наличие специфического N-конца (например, белки с основными аминокислотами на N-конце менее стабильны), или посттрансляционные модификации (например, фосфорилирование, убиквитинирование).
Разрушение белков происходит в лизосомах и протеасомах - в лизосомах разрушаются внеклеточные и мембранные белки посредством эндоцитоза, в протеасомах разрушаются внутриклеточные белки.
Протеасома построена из центрального кора, состоящего из 14 белковых димера, по 7 в кольцевой структуре. Всего 4 кольца расположенных друг над другом; две регуляторные части с двух сторон от кора, 14 белков в каждой, 6 из которых ATP-азы. Некоторые из субъединиц узнают убиквитин - белок, состоящий из 76 аминокислот. (рис.1).
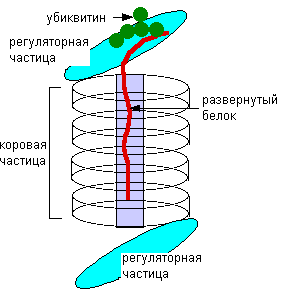
рис.1 Схема протеасомы.
Белок подвергающийся протеолизу соединяется лизиновым остатком с С-концом убиквитина (рис.2), дополнительные молекулы убиквитина присоединяются формируя цепь, которая связываетя с регуляторной частью протеасомы. Степень убиквитинирования имеет разные последствия для белка. Например, 48 остатков убиквитина присоединенные к белку служат сигналом протеасомного разрушения, тогда как 63 остатка служат посттрансляционным сигналом в различных клеточных процессах, таких как ДНК репарация, актвация транскрипционных факторов и др.
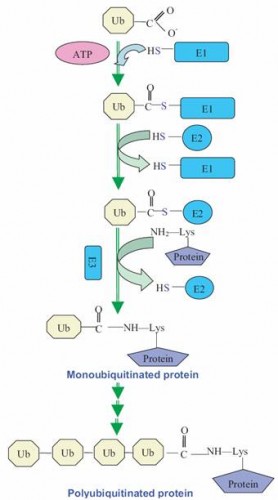
рис.2 Схема присоединения убиквитина к белку и участие различных ферментов.
Фермент Е1 активирует С-конец убиквитина, используя энергию АТФ, аденилированием и переносом тиоэфирной связи с цистеина на E1. Фермент Е1 переносит убиквитин к транспортноми ферменту Е2, который при помощи Е3 лигазы присоединяет его к субстрату.
Было обнаружено несколько генов кодирующих Е1, десятки генов Е2 и сотни Е3. Используя разные комбинации ферментов клетка регулирует какой белок должен быть разрушен и скорость распада.
Развернутый белок перемещается в пространство коровой частицы, где специфически разрезается на короткие пептиды ~8 аминокислот, которые впоследствии могут быть разрушены пептидазами цитозоля.
Нобелевская премия по химии за 2004 год была получена Avram Hershko, Aaron Ciechanover и Irwin Rose за исследование убиквитинирования белков, ведущее к их протеолизу.
Центросома
 Микрофотография центросомы
Микрофотография центросомы
Центросома состоит из материнской и дочерней (смотрит на материнскую) центриолей – диплосома – погружена в матрикс от которого отходит центросфера – фибриллы МТ, связанные с центросомой (–)концом. Часто около Я (связаны ПФ) или АГ. Центросом нет у высших раст, низших грибов и нек. простейших. Участвует в образ веретена деления
Центриоль - 9 триплетов МТ, под 400,образ полый цилиндр, l = 0,3-0,5мкм (до неск мкм), h=0,15мкл, состоящие из разных пидов:а,b,d,e-тубулинов, центрин, тектин, и другие ассоциированные стр-рные белки. А-МТ – полная – 13субъед, В,С – неполные 11 субъед. От А отходят ручки – 1 к соседней С, 2 – в центр центриоли. Центриоли богаты полиглутаминовым тубулином
дочерняя центриоль - на проксимальном конце (где сходятся центриоли)– центральная втулка – колесо d=25нм (иногда аморфный материал), 9 спиц – направлены к А – структура занимает ? - 1/5 длины центриоли
материнская центриоль имеет придатки – сателлиты: ножка сателлита (соед с центриолью, часто поперечно исчерчена), головка сателлита – фокус схождения мт. Центром организации мт является только материнская ценриоль
Матрикс -аморфный материал, окружает диплосому - состоит из разных белков: g-тубулиновые кольцевые комплексы - центры орг микротрубочек. Матрикс состоит из множества белков включая моторные белки, биспиральные белки связывающие моторные белки с центросомой, структурные белки и белки связанные с контролем кц.
ЦЕНТРОСОМНЫЙ ЦИКЛ
М 2диплосомы. мт веретена отрастают от фибриллярного гало – 0,3мкм зона вокруг материнской центиоли, в это время отсутствуют сателлиты – 1активность центросом. В нек клетках две астры разделяются когда ядерная об-ка уже начинает разрушаться, в др. астры разделены перед концом профазы
прометафаза При разрушении лазером центриолей рост мт останавливается
метафаза
анафаза
телофаза Толщина фибриллярного гало уменьшается. Материнская и дочерняя центриоли теряют перпендик. ориентацию и отходят др от друга на 0,5-2мкм, но держатся вместе. Гало отсутствует, мт в цитоплазме почти нет
G1 1 диплосома. На матер. центриоли возникают сателлиты, от кот растут мт и заполняют цитоплазму – 2 активность центросом. От центросом отходят неск 10 мт, в клетке же их на много больше ? растущие мт могут отделяться от центросом и находится в цитоплазме довольно долго?в клетке есть не связанные (старые) и связанные (новые) с центросомой мт
Центросома способна образовать ресничку – 3активность: мт реснички отрастают от А и В материнской центриоли в ее дистальной части
S Удвоение центиолей – 4активность (поздняяG1-ранняя S): около разошедшихся центриолей закладываются процентриоли, сначало 9 синглетов, затем 9 дуплетов и затем 9 триплетов мт на проксим концах. Удвоенные центросомы остаются вместе как один комплекс. Центриоли растут во время S или G2 и могут не достигнуть своей полной длины до следующей G1Во время удвоения материнская продолжает служить центром орг мт. Между плоидностью клеток и числом центросом имеется прямая связь
G2 2 диплосомы. Исчезают сателлиты. Центросомы расходятся с помощью микротрубочкозависимых моторных белков. фосфорилирование EF-головки центрина во время G2/профазы кореллирует с разделением центросом. Киназная активность Nek2 и фосфорилирование центрина координирует разделение центросом с вхождением в митоз.
Литература.
Цитоскелет
Раздел посвщённый изучению скелета клетки - цитоскелету
Микротрубочки
Параметры микротрубочек
Время полужизни микротрубочки ~5 мин, во время первой половины митоза ~15c
Диаметр микротрубочки 25нм.
Образование микротрубочек
Структурной единицей микротрубочки является гетеродимер белка тубулина, состоящий из α- и β-субъединиц (53 и 55 кДа), не прибывающих по отдельности, схожие но не идентичные. Каждая из субъединиц имеет сайт для связывания нуклеотида. α-тубулин связывает молекулу GTP, которая не гидролизуется, β-тубулин может связывать GDP или GTP (рис.1). β-тубулин одного гетеродимера связывает GTP и соединяется с α-тубулином другого гетеродимера, при этом GTP гидролизуется до GDP. α-тубулин является GTP-активирующим белком и катализирует гидролиз GTP β-тубулина (рис.2). Таким образом гетеродимеры образуют линейные цепочки – протофиламенты, 13 протофиламентов образуют спиральный циклический комплекс, такие кольца полимеризуются в трубку (рис.3). Фосфорилирование тубулина усиливает полимеризацию.

рис.1 Гетеродимер тубулина. α-тубулин (син.) с сайтом связывания GTP (голуб.). β-тубулин (зел.) с сайтами связывания GTP и GDP (красн.)
Микротрубочки - динамические полярные стр-ры. (+)-конец динамически нестабильный (β-тубулин) и (-)-конец стабилизируется, связываясь с центром организации микротрубочек (см. обзор Центросома).
Тредмиллинг - движение микротрубочек в результате одновременного наращивания одного конца и диссоциации другого конца микротрубочек.
ДНК тубулина в нуклеотид-связывающем домене имеет высококонсервативную последовательность GGGTG(T/S)G.
Бактериальный белок FtsZ - гомолог тубулина является компонентом бактериального цитоскелета и полимеризуется с образованием микротрубочек.
 Микротрубочки
Микротрубочки
рис.2 Микротрубочки способны образовывать синглет, дублет и триплет.
A микротрубочка дублета или триплета состоит из 13 протофиламентов.
Трубочки B и C состоят из меньшего числа протофиламентов, обычно 10.
Белки соединяющиеся с микротрубочками.
С микротрубочками ассоциируют два вида белков: структурныерные
белки (MAP-microtubuls-associated proteins) и белки транслокаторы.
Присоединение MAP регулируется фосфорилированием, в результате
которого некоторые MAP отсоединяются от микротрубочек.
+TIPS - белки взаимодействующие с (+)-концом
микротрубочки, многие из которых являются моторными белками,
другие обеспечивают взавимодействие с микрофиламентами в
клеточном кортексе, присоединяя микротрубочки к плазматической
мембране. Некоторые +TIPS регулируют динамику микротрубочек
и стабильность (+)-конца, например, XMAP215
семейство белков стабилизирует (+)-конец предотвращая разрушение
и обеспечивая рост микротрубочек.
CLASP - белки обеспечивающие присоединение
димеров тубулина к (+)-концу и ингибируют катастрофины.
Они взаимодействуют с кинетохором - комплексом который соединяет
(+)-конец микротрубочки с хромосомой.
Катастрофины - +TIP белки связывающиеся с (+)-концом микротрубочек
и обепечивающие диссоциацию димеров тубулина. Они способны
активировать гидролиз GTP или изменение конформации протофиломентов
(MCAK - кинезин, располагающийся в кинетохоре
и обеспечивает диссоциацию (+)-конца во время анафазы митоза).
Стасмин - дестабилизирующий белок, находящийся
в раковых клетках. Присоединяется с тубулиновым гетеродимером
затрудняя их полимеризацию. Стасмины ингибируются фосфорилированием.
Катанин - разделяет микротрубочки образуя новый нестабильный
(+)-конец.
НекоторыеMAP соединяют микротрубочки
друг с другом, с мембраной или промежуточными филаментами.
Тип I MAP обнаружен в аксонах и дендритах нервных клеток
и некоторых других имеет несколько повторов KKEX (Lys-Lys-Glu-X)
которые связывают (-)-заряженные участки тубулина.
Тип II MAP также обнаружен в аксонах и дендритах нервных
клеток и некоторых других. Они имеют 3-4 повтора из 18 остатков
последовательности, которая присоединяет тубулин.
Белки взаимодействующие с (+)-концом микротрубочек
APC, Kar9 (Sc)*
APC (adenomatous polyposis coli) - опухолевый супрессор,
являющийся основой для белкового комплекса регулирующего
фосфорилирование b-катенинов.
EB1, Bim1(Sc), Mal3 (Sp)
EB1 (end-binding protein 1) - белок взаимодействующий с
APC.
Nud (An)
Nud (nuclear distribution) - белок регулирующий динеины.
Lis1/NUDF (An), Pac1 (Sc)
Lis (lissencephaly) - нарушение развития человеческого мозга
(гладкий мозг). Белок взаимодействует с динеином регулируя
его функцию.
NUDE (An), R011 (Neurospora
crassa)/Ndl1 (Sc); Nde1, Ndel1
(млекопитающие).
Эти белки взаимодействуют с Lis1 и денеинами и обеспечивают
их функционирование.
Kar3 (Sc)
Kar3 - кинезин, имеющий C-концевой моторный домен и пренадлежит
к семейству Kinesin-14.
Kip2(Sc), Tea2
(Sp), KipA (An)
Кинезины грибов принадлежащие семейству Kinesin-7 включающее
CENP-E - центромерный белок млекопитающих, Kip2 , Tea2 and
KipA
Klp10A (Dm), Klp59C, MCAK
Члены семейства Kinesin-13. Klp10A - предполагаемый гомолог
Kif2A млекопитающих. Klp59C (Dm) - предпоплагаемый гомолог
MCAK млекопитающих. KLP10A и другие члены Kin I
субсемейства кинезинов взаимодействующих с некепированным
(-)-концом микротрубочек веретена деления во время митоза.
Они обеспечивают диссоциацию тубулиновых димеров полюсов
клетки, способствуя тедмиллингу (движению
микротрубочек к полюсам и укорочение микротрубочек во время
анафазы митоза).
Dynactin
Комплекс белков включающий белок p150glued. Динактин связывает
динеин и регулирует его свойства, а такжи присоединяет везикулы
к динеину. p150glued - гомолог NUDMA. nidulans.
CLIP-170, Bik1 (Sc), Tip
(Sp)
CLIP-170 обеспечивает стабилизацию и рост микротрубочек,
а так же регулирует локализацию динеина.
СLIP-170 - обеспечивает посадку комплекса динеин-динактин,
участвующего в транспорте везикул, на конец микротрубочки.
LIP-170 находится в цитоплазме в неактивной конформации
в которой N-конец связывающийся с микротрубочкой связан
с С-концом той же молекулы. При связывании N-конца с тубулином
или (+)-концом микротрубочки, C-конец освобождается и связывается
с комплексом динеин-динактин через молекулу p150Glued, микротрубочка
стабилизируется. Диненин-динактин освобождается и начинает
движение вдоль микротрубочки (рис.3)
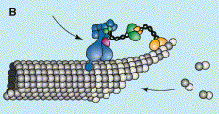
Некоторые токсины и лекарства, некоторые из которых нарушают митоз влияют на полимеризацию и деполимеризацию тубулина:
таксол - противоопухолевое лекарство, стабилизирует микротрубочки.
колхицин связывает тубулин блокируя полимеризацию. Микротрубочки деполимеризуются при высокой концентрации колхицина.
винбластин - усиливает деполимеризацию образуя паракристаллы винбластин-тубулин.
нокодазол - обеспечивает деполимеризацию микротрубочек.
Ассоциация подавляется винбластин, винкристин, колхицин, усиливается – таксол.
Гамма-сома – центр организующий микротрубочки на внешней поверхности ядра.
Микрофиламенты
G-актин
мономер G-актин (глобулярный актин)- ассиметричный
(42кДа) состоит из двух доменов, по мере повышения ионной
силы агрегирует в скрученный в спираль полимер F-актин (фибриллярный
актин).
G-актин имеет участки связывания двухвалентных катионов
и нуклеотидов в физиологических условиях занятые Mg2+
и ATP.
Полимеризация G-актина в F-актин
F-актин обладает полярностью (+) и (-) имеющих
различные свойства.
Молекула G-актина несет прочно связанную АТФ, который при
переходе в F-актин медленно гидролизуется до АДФ – проявляет
свойства АТФ-азы Полимеризация сопровождается гидролизом
АТФ, что не необходимо т.к. полимеризация идет и в присутствии
негидролизуемых аналогов АТФ
Полимеризация состоит из нескольких процессов: нуклеация,
элонгация, диссоциация,
фрагментация, стыковка.
Эти процессы протекают одновременно.
Нуклеация – соединение трех G-актинов –
инициация полимеризации.
Элонгация - наращивание цепи актина путем
присоединения G-актина к (+)-концу F-актина.
Диссоциация - укорачивание цепи. Деполимеризация
актина имеет одинаковую скорость с обоих концов
Фрагментация - в результате теплового движения
F-актин может фрагментироваться.
Стыковка - отдельные фрагменты могут соединяться
друг с другом конец в конец.
При конценрации G>F – одновременно происходит полимеризация
(+) и (–) конца.
Если G<F – происходит полимеризация (+) и деполимеризация
(–)-конца – тредмиллинг – движение F-актина
за счет одновременного наращивания (+)-конца и диссоциации
(-)-конца. При G ~ F – динамическое равновесие - происходит
полимеризация (+) и деполимеризация (–)-конца с затратой
энергии ATP G-актин связ с ATP и полимеризуясь гидролизует
ATP.при критических конц G-актина (+) конец удлиняется,
а (-) – укорачивается
Актиновые микрофиламенты
F-актин – фибриллярный, длина оборота спирали 37
нм, d=6-8нм.
Актинсвязывающие белки
Более 50 белков в цитоплазме связываются с актином выполняя
различные функции: регулируют объем G-актинового пула (профилин),
влияют на скорость полимеризации (виллин), стабилизируют
концы нитей (фрагин, а-актинин), сшивают филаменты др с
др или с др компонентами (виллин, α-актин, спектрин,
MARCKS, фимбрин), разрушают двойную спираль F-актина (гельзолин).
Активность этих белков регулируется Ca2+ и протеинкиназами.
Имеется пять мест действия белков: с мономером
актина, с (+)-концом (оперенный), с (-)-концом (заостренный),
с боковой поверхностью. Актин-связывающие белки могут быть
чувствительны или нечувствительны к Ca2+
1. Белки связывающиеся c мономером актина - подавляют нуклеацию
(профилин, фрагментин - чувствительны к Ca2+).
Профилин с мономером способны надстраивать F-актин, а фрагментин
нет, блокируя и нуклеацию и элонгацию. Не чувствительные
к Ca2+ ДНКазаI и белок связывающийся с витамином
D - функционируют вне клетки.
2. Кепирующие(+)-конец может быть блокирован кепирующими
белками - блокирование элонгации и стыковки, способствуют
нуклеации - появление укороченных филаментов (гельзолин,
виллин, фрагмин)
3. (-)-конец - инициирование нуклеации, подавление стыковки
и элонгации - увеличение числа и уменьшение длины фрагментов.
Акументин в макрофагах, бревин - сывороточный белок вызывает
быстрое снижение вязкости раствора F-актина. Оба белка не
чувствительны к Ca2+
4. Не сшивающие - боковое связывание может как стабилизировать
так и дестабилизировать F-актин Тропомиозин (Ca-независим)
стабилизирует, северин, виллин (Ca-зависим) - связываясь
с F-актином разрезают его.
5. Сшивающие F-актин между собой с образованием геля. Такие
белки индуцируют нуклеацию. Такие белки димерны или имеют
два актин-связывающих домена. α-актин тромбоцитов,
виллин, фимбрин, актиногелин из макрофагов (Ca-независим).
кэпирующие белки - закрывают концы актиновых
филаментов, предотвращая полимеризацию-деполимеризацию,
способствуют прикреплению филамента к мембране.
фаллоидин – яд бледной поганки, связывается
с (-)-концом и ингибирует деполяризацию.
цитохалазин – токсин плесневых грибов присоединяется
к (+) концу, блокируя полимеризацию.
кэпирующие-фрагментирующие белки - фрагментируют
F-актин, вызывая переход геля в золь (гельзолин 90kD активируясь
Ca2+ 10-6M разрывает F-актин и связывается с его концами).
белки связывающие F-актин
| белок | M, kD | рис. | локализация и действие на F-актин |
| фасцин | 55 | филлоподии, ламелоподии, стресс-фибриллы, микроворсинки, акросома |
|
| тропомиозин | 2x35 | стабилизирует F-актин, предотвращая фрагментацию | |
| миозин | 2x260 | скольжение нитей | |
| минимиозин | 150 | движение пузырьков | |
| профилин | 15 | запасение G-актина | |
| скруин | 102 | акросома | |
| вилин | 92 | микроворсинки | |
| дематин | 48 | кортикальная сеть эритроцитов | |
| фимбрин | 68 | адгезион. контакты, микроворсинки связ в пучки | |
| актинин | 2x102 | адгез контакты, микроворсинки связ в пучки | |
| спектрин | 2x265+2x260 | кортик сеть эритроц прикрепление к ПМ | |
| дистрофин | 427 | корт.сеть мыш волокон | |
| ABP120 | 92 | псевдоподии | |
| филамин | 2x280 | псевдоподии, стрессфибриллы сшивает в сети |
Структуры образуемые актином
Клеточный кортекс – сеть из актиновых филаментов
под плазматической мембраной.
Филлоподии
Стресс-фибриллы - образуются, когда у клетки есть
возможность прикрепиться к субстрату
Промежуточные филаменты
ПРОМЕЖУТОЧНЫЕ ФИЛАМЕНТЫ
белки промеж филаментов клетки число M, kD тип
кислые кератины эпит >15 40-57 I
основные кератины эпит >15 53-67 II
десмин мыш 1 53 III
кислый фибриллярный белок глиальн, астроциты 1 50
виментин мезенх, нек эпит 1 57
периферин нервные 1 57
белки нейрофиламентов: аксоны и дендриты IV
NF-L 1 62
NF-M 1 102
NF-H 1 110
интернексин ЦНС 1 66
нестин эпит нервн ткани 1 240
ламин A ядра всех клеток 1 70 V
ламин B 1 67
ламин С 1 67
септамерный мономер?параллельный димер?антипараллельный тетрамер?протофиламент? протофибрилла?ПФ
промежуточные филаменты
d=10нм, (цитокератины, десмин, виментин, кислый фибриллярный глиапротеин (GFAP), нейрофиламент) состоят из базовой стержневой стр-ры – суперспирализованная -спираль, такие димеры ассоциируют антипараллельно, образуя тетрамер, агрегация тетрамеров «голова к голове» дает протофиламент, 8 протофиламентов образ. промежуточное волокно | полимеризация ведет к образ. устойчивых неполярных полимерных молекул
белки связанные с ПФ
белок M, kD локализация
BPAG1 230 полудесмосомы
плакоглобин 3 десмосомы
десмоплакинI 250 десм
десмоплакинII 215 десм
плектин 300 кортек. зона
анкирин 140 кортек. зона
филаггрин 30 цитозоль
рецептор B-ламина 58 ядро
У мутантов мышей отсутствует виментин, мыши при этом живут совершенно нормально.
В растительных клетках цитоскелет представлен микротрубочками и микрофиламентами, промежуточных филаментов нет, но есть ламины
Реснички
Ресничка - вырост цитоплазмы h=300нм, покрытый пм
аксонема – d=200нм, 9 дублетов микротрубочек, 100, 2 центральные микротрубочки, А-микротрубочка - 13 субъединиц, В-микротрубочка – 11 субъединиц,
базальное тельце - погружено в цитоплазму d = 200 нм, 9 триплетов микротрубочек, имеет ручки, втулку и спицы в проксимальной части.
Скорость движения клеток за счет ресничек может достигать ~5мм/c. Число ресничек в кл трахеи ~300, в клетке инфузории ~14тыс.
кинетоцилии – способные к движению (эпителии, спермии), первичные реснички – не двигаются.
Эндоплазматический ретикулум
Эндоплазматический ретикулум (ЭР) - это замкнутая система мембранных трубочек внутри клетки, образующих сложную переплетающуюся сеть.
Замкнутая мембрана занимает порядка 10% объема клетки. Увеличение поверхности мембраны внутри клетки по сравнению с плазматической мембраной повышает отношение поверхности клетки к ее объему и необходимо для эффективного протекания различных метаболических процессов. Кроме того эндоплазматический ретикулум участвует в транспорте различных биомолекул.
Селективная передача молекул из цитозоля в ЭР
ЭР принадлежит центральная роль в липидном и белковом синтезе - на мембране ЭР синтезируются все трансмембранные белки и липиды для большинства органелл, включая сам ЭР, Аппарат Гольджи, лизосомы, эндосомы, секреторные везикулы и плазматическую мембрану. ЭР продуцирует большую часть липидов митохондрий.
ЭР участвует в экскреции продуктов из клетки.
Вещества синтезируемые в ЭР предназначены для клеточных компартментов, а не для цитозоля.
Гладкий ЭР
Метаболизм липидов
Шероховатый ЭР
Синтез белка на ШЭР
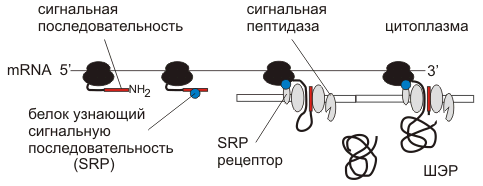
Рибофорины – два гликопротеина ШЭР, которые узнает большая субъед рибосомы.
Белки предназначенные для шероховатого эндоплазматического ретикулума имеют гидрофобную сигнальную последовательность на N-конце полипептида. После того как на рибосоме синтезирована сигнальная последовательность дальнейший рост полипептидной цепи ингибируется. Белок узнающий сигнальную последовательность (SRP) связывается с ней и соединяется с рецептором на поверхности ШЭР. Рибосома соединяется с каналом и рост полипептидной цепи возобновляется. При этом синтезируемый белок проникает внутрь ШЭР. Рецептор может являться частью канала. Сигнальная пептидаза на внутренней стороне ШЭР отрезает сигнальную последовательность синтезированного белка.
После отщепления сигнальный пептид остается в мембране и разрушается с помощью протеазы. В митохондриях и хлоропластах должно присутствовать несколько сигнальных пептидаз.
сигнал распознающая частица - рибонуклеопротеиновый комплекс, состоящий из шести разных белков и молекулы 7S-РНК. СРЧ
связывается с сигнальной последовательностью образующегося полипептида во время его синтеза на рибосоме. Защитная функция
Некоторые небольшие белки (<7 кДа) транспортируются в эндоплазматический ретукулум независимо от СРЧ. Конформация таких белков не требует стабилизации СРЧ и рибосом.
Сигнальная последовательность на образующейся полипептидной цепи перемещается от РЧ ко второму рецептору находящемуся в мембране и называемому рещептором сигнальной последовательности. Рецептор может являться частью канала.
доставка каждого белка к месту его назначения обеспечивается набором сигналов, кодируемых в каждом полипептиде.
Ядро
Раздел, в котором изучается организация центральной органеллы клетки - ядра
Основные сведения
В состав ядра входит ядерная оболочка, хроматин, ядрышко, ядерный белковый матрикс, нуклеопротеидные комплексы, кариоплазма.
В ядрах не происходит синтеза белков
рис. [577K] Ядро клетки. Видны наружная и внутренняя мембраны, темный гетерохроматин и зернистый светлый эухроматин.
рис. [213K] Ядро клетки имеет многочисленные выросты, что свидетельствует, наряду с развитым эндоплазматическим ретикулумом, о высоком уровне метаболизма клетки.
Ядерная оболочка
Ядерная оболочка - мембранный барьер, отделяющий ядро от цитоплазмы. Она контролирует перемещение макромолекул между нуклеоплазмой и цитозолем, участвует в заякоревании хромосом и цитоскелета, являясь частью регуляторного механизма экспрессии у эукариот.
Мутации в белках ядерной оболочки проявляются в виде различных заболеваний, таких как мышечная дистрофия, нейропатия, липидодистрофия, преждевременное старение (см. обзор Синдром преждевременного старения).
В состав ядерной оболочки входят мембрана, ядерный поровый комплекс и ламина.
Ядерная оболочка образована внешней и внутренней мембранами. Наружная мембрана переходит в шероховатый эндоплазматический ретикулум, и обеспечивает присоединение структурных элементов цитоплазмы. Вутренняя выстлана белками – ламининами, образующими ядерную пластинку, которая закрепляет различные ядерные структуры. Между мембранами располагается перинуклеарное пространство.
В состав ядерной оболочки также входит поровый комплекс (см. обзор Ядерный поровый комплекс).
Ламина представляет собой густую сеть выстилающую внутреннюю мембрану изнутри и состоящую из промежуточных филаментов - ламинов и взаимодействующих с ними белков. Ламина необходима для сохранения целостности ядра.
Ламина – структура и образованная белками ламинами А, B, C. A и C – производные одного гена образующиеся при альтернативном спайсинге. Ламин А содержит 113 добавочных аминокислот. Ламин В связан с липидным слоем изопрениловым якорем. Три ламины образуют димеры, имеющие стержневидный домен из а-спиралей и глобулярные домены на каждом конце. Эти домены полимеризуются и образуют сетеподобную структуру.
Ядерный поровый комплекс
 Микрофотография ЯПК
Микрофотография ЯПК
Ядерный поровый комплекс (ЯПК) – восмиугольный цилиндр в состав которого входит ~100-200 белков, М=124x106 D.| Молекулы M<9kD свободно проходят через водный канал ЯПК, молекулы M>9kD перемещаются путем активного транспорта используя ядерный сигнал с затратой энергии ГТФ. Ламина связана с липопротеиновым комплексом внутренней ядерной мембраны. Импортин – белок 60kD узнает сигнальную последовательность из 6 аминокислот - PPKKKKAKV в полипептиде который транспортирует через ядерную оболочку. В ядерном импорте участвуют различные цитоплазматические факторы. ядерные поры – d=7 нм небольшие белки легко проникают в ядро; белки >40 кДа проникают, если содержат сигнальную последовательность.
В начале профазы киназы фосфорилируют ламину, которая разрушается, липопротеиновый комплекс ядерной мембраны распадается на везикулы, наружная мембрана сливается с ЭР, содержимое ядра распределяется в цитозоле. В поздней анафазе цитоплазматические фосфатазы дефосфорилируют ламины, которые полимеризуются на поверхности хромосом, везикулы сливаются образуя ядерную оболочку.
Биосинтез NAD+ -предшественник кофермента, никотинамидмононуклеотид НАМ (NMN) синтезируется в цитоплазме и транспортируется в ядрышко для превращения в динуклеотид NAD+, который после этого возвращается в цитоплазму.
ЯПК - белковый комплекс массой ~125 МДа у метазой и ~66 МДа у грибов, состоящий примерно из 30 различных белков, называемых нуклеопорины.
review 17-19, 26-30. Нуклеопорины разделяют на имеющие FG-повторы, которые непосредственно участвуют в транспорте, и не имеющие FG-повторы, представляющие собой структурные компаненты ЯПК.
Помимо транспортной функции нуклеопорины имеют также дополнительные функциии:
Ядрышки
 Микрофотография ядрышка
Микрофотография ядрышка
Ядрышко- хромосомные участки, определяющие синтез рРНК и образование клеточных рибосом. В растущих ооцитах неск сот ядрышек - амплификация ядрышек. Ядрышки отсутствуют в клетках дробящихся яиц и в дифф. кл - клетки крови
Число ядрышек зависит от числа ядрышковых организаторов - участки, на кот в телофазе происх образование ядрышек интерфазного ядра - образуют вторичные перетяжки х-м. У человека яо расп в коротких плечах 13, 14, 15, 21 и 22 хромосом (10 на диплоидный набор). 82). У кошки - 2; у свиньи - 2; у мыши - 4; у коровы - 8. У хладнокр. позвоночных и птиц обычно 1пара яо х-м
Локализация яо определяется на митотических х-мах окраской солями серебра, связ с яо белками, более точно определение яо методом FISH. Ядрышки могут сливаться др с другом.
Множественность рибосомных генов
при разрыве х-мы на месте вторичной перетяжки ядрышки могут
возникать на каждом из фрагментов х-м – множество копий рибосомных генов - полицистроны - умеренные повторы. У E. coli 6-7 рассеянных по геному идентичных оперонов рРНК- ~1% всей ДНК. Число генов рРНК постоянно в клетке
Амплифицированные ядрышки - гены рРНК мб избыточно реплицированы. При этом дополнительная репликация генов рРНК происходит в целях обеспечения продукции большого количества рибосом. В результате такого сверхсинтеза генов рРНК их копии могут становиться свободными, экстрахромосомными. Эти внехромосомные копии генов рРНК могут функционировать независимо, в результате чего возникает масса свободных дополнительных ядрышек, но уже не связанных структурно с ядрышкообразующими хромосомами. Это явление получило название амплификации генов рРНК. подробно изучено на растущих ооцитах амфибий.
У X. laevis амплификация рДНК, происходит в профазеI. В этом случае количество амплифицированной рДНК (или генов рРНК) становится в 3000 раз больше того, что приходится
на гаплоидное количество рДНК, и соответствует 1,5х106 генов рРНК. Эти сверхчисленные внехромосомные копии и образуют сотни дополнительных ядрышек в растущих ооцитах. В среднем же на одно дополнительное ядрышко приходится несколько сот или тысяч генов рРНК.
Амплифицированные ядрышки встречаются также в ооцитах насекомых. У окаймленного плавунца в ооцитах обнаружено 3х106 экстрахромосомных копий генов рРНК.
После периода созревания ооцита при его двух последовательных делениях дополнит ядрышки в состав митотических хромосом не входят, они отделяются от новых ядер и деградируют.
У Tetrachymena pyriformis в гаплоидном геноме микронуклеуса единственный ген рРНК. В макронуклеусе ~200 копий.
У дрожжей экстрахромосомные копии генов рРНК - циклические ДНК l~3 мкм, сод один ген рРНК.
СТРУКТУРА ЯДРЫШКА
В ядрышке различают гранулярный компанент (гк) и фибриллярный компанент (фк).
Гранулярный компанент представляет собой
гранулы 15-20 нм, обычно расположенные на периферии ядрышка, хотя гк и фк могут быть распределены равномерно.
Фк и гк способны образовывать нитчатые структуры - нуклеолонемы - ядрышковые нити ~100-200 нм, которые могут образовывать отдельные сгущения.
Фибриллярный компанент - представляет собой тонкие (3-5 нм) фибриллы - диффузная часть ядрышек, в центре ядрышка – 1 или 3-5 отдельных зон: фибриллярные центры - частки скопления фибрилл с низкой е лотностью, окруженные зоной фибрилл высокой е плотности - плотный фибриллярный компонент
хроматин – примыкает или окружает ядрышко. 30нм фибриллы хроматина по периферии ядрышка могут заходить в лакуны, м-у нуклеолонемными участками.
белковый сетчатый матрикс –
метод регрессивного окрашивания нк - ионы уранила, связанные с ДНК легко вымываются хелатоном ЭДТА, чем с РНК?окрашенные структуры сод РНК: гранулы (сильно), пфк (слабее), хроматин (не окрашен)
импульсное мечение (3H-уридин), первые следы мечения обнаруживались сначала (через 1-15 мин) в пфк, а затем (до 30 мин) меченым оказывался гк. в фц метка не обнаруживалась?45S пре-рРНК синтезируется в области пфк, а гранулярный компонент ядрышка соответствует прерибосомным частицам (55S-, 40S РНП).
окрашивание осмий-амином, ДНКазы, меченной золотом, связыванием меченого актиномицина, прямой молекулярной гибридизацией с меченой рДНК - что в составе фибриллярных центров находится ДНК, ответственная за синтез рРНК. Зоны фибриллярных центров отличаются от остального хроматина тем, что состоят из тонких хроматиновых фибрилл, значительно обедненных гистоном H1 (что показано с помощью меченных коллоидным золотом антител).
фц: неактивные рибосомные гены, спейсерные участки.
Транскрипция пре-рРНК происходит по периферии фц, где пфк и представляет собой 45S пре-рРНК, располагающиеся в виде “елочек” на деконденсированных участках рДНК После завершения
транскрипции 45S РНК теряет связь с транскрипционной единицей на ДНК в зоне плотного фибриллярного компонента, каким-то еще непонятным образом переходит в гранулярную зону, где и происходит процессинг рРНК, образование и созревание рибосомных субъединиц.
Фибриллярный центр и ядрышковый организатор
Строение и химические характеристики ФЦ оказались практически одинаковыми с таковыми ядрышковых организаторов митотических хромосом. И те и другие построены из тесно ассоциированных фибрилл, толщиной 6-10 нм; и те и другие обладают характерной особенностью - окрашиваться солями серебра, что зависит от наличия особых ядрышковых белков, содержат РНК-полимеразу I.
число ФЦ в интерфазных ядрышках, не соответствует числу ядрышковых организаторов в митозе. Так в клетках культуры СПЭВ число ФЦ может быть в 2-4 раза выше, чем число ядрышковых организаторов .
Более того, количество ФЦ возрастает по мере увеличения плоидности клетки (G2, 4n) и транскрипционной ее активности.
При этом уменьшается величина каждого отдельного фибриллярного центра. Однако суммарные объемы ФЦ при пересчете на гаплоидный хромосомный набор остаются постоянными в интерфазе, но превышают это число вдвое по сравнению метафазой. Другими словами при активации синтеза рРНК наблюдается такое изменение числа ФЦ и их размеров, которое может говорить о какой-то фрагментации исходных ФЦ в относительно мало активных ядрышках.
Противоположная картина наблюдается при затухании синтетических процессов в дифференцирующихся клетках эритроидного ряда мышей (табл. 12). При этом видно, что в размножающихся и активно синтезирующих гемоглобин проэритробластах количество фибриллярных центров зависит от плоидности клетки (88 в G1-фазе, 118 в G2-фазе клеточного цикла), размер индивидуальных ФЦ изменяется мало. После прекращения размножения этих клеток и падении их синтетической активности резко меняются параметры ядрышка. Их объем, уже начиная со стадии базофильного эритробласта
уменьшается в 4-5 раз, а на конечной стадии дифференцировки (нормобласт) - в сотню раз. При этом резко падает число ФЦ (10-40 раз) и возрастает объем почти в 10 раз величины отдельного фибриллярного центра.
Исходя из этих наблюдений можно так представить общую схему активации и инактивации ядрышка (рис. 90) на примере одного ядрышкового организатора.
В неактивной форме ядрышковый организатор представлен в виде одного крупного фибриллярного центра, включающего в себя компактно уложенную часть цепи хромосомной ДНК, несущей тандемно расположенные рибосомные гены (транскрипционные единицы). В начале активации ядрышка происходит деконденсация р-генов на периферии такого фибриллярного центра, эти р-гены начинают транскрибироваться, на них образуются РНП-транскрипты, которые при созревании дают начало появлению гранул - предшественников рибосом по периферии активированного ядрышка. По мере усиления транскрипции единый фибриллярный центр как бы распадается
на ряд более мелких фибриллярных центров, связанных друг с другом полностью декомпактизованными участками рДНК. Чем выше транскрипционная активность ядрышка, тем больше число мелких, связанных друг с другом фибриллярных центров, окруженных плотным фибриллярным компонентом (ПФК), содержащим 45S рРНК. При полной активации ядрышка все мелкие фибриллярные центры деконденсируются; в этом случае зоны плотного фибриллярного компонента содержат всю рДНК, находящуюся в активном состоянии. Такая структура наблюдается у амплифицированных ядрышек растущих ооцитов. В случае инактивации ядрышка происходит постепенная конденсация рДНК, снова образуются фибриллярные центры, они объединяются друг с другом, величина их растет параллельно уменьшению доли ПФК. При полной инактивации, как в случае нормобластов, ядрышко представлено одним крупным (4-5 мкм) сферическим ФЦ, без сопутствующего транскрипции ПФК: оно окружено зоной конденсированного хроматина. Такое инактивированное ядрышко сходно по своим структурным особенностям
с ядрышковым организатором в составе митотических хромосом.
Структурные типы ядрышек
Приведенные выше описания дают основу для понимания разнообразия строения ядрышек в клетках с соответствующим уровнем синтеза рРНК. Однако кроме различной степени выраженности гранулярного и фибриллярных компонентов существуют и иные варианты структурной организации ядрышек. Обычно различают несколько структурных типов ядрышек: ретикулярный или нуклеолонемный, компактный, кольцевидный, остаточный (покоящийся), сегрегированный (рис. 91).
Ретикулярный тип ядрышка наиболее характерен для большинства клеток, для него свойственно нуклеолонемное строение, обилие гранул и фибриллярного плотного материала. Во многих случаях фибриллярные центры выявляются плохо, вероятно из-за высокого уровня транскрипции. Этот тип ядрышек встречается в клетках животных и растений. Так, например, ретикулярный тип ядрышка, свойственный гигантским политенным хромосомам двукрылых насекомых, очень сходен с таковым на гигантских хромосомах
антиподиальных клеток ячменя.
Компактный тип ядрышка отличается от предыдущего меньшей выраженностью нуклеолонемы, большей частотой встречаемости фибриллярных центров. Такие ядрышки характерны для активно размножающихся клеток (клетки растительных меристем, клетки культуры ткани и др.). Вероятно, что оба эти типа могут переходить друг в друга, во всяком случае, они чаще всего встречаются в клетках с высоким уровнем синтеза РНК и белка.
Кольцевидные ядрышки встречаются в клетках животных. В световом микроскопе они имеют форму кольца с оптически светлой центральной зоной - это фибриллярный центр, окруженный РНП-фибриллами и гранулами. Размер этих ядрышек составляет около 1 мкм. Типичные кольцевидные ядрышки характерны для лимфоцитов, эндотелиоцитов,т.е. для клеток с относительно низким уровнем транскрипции.
Остаточные ядрышки характерны для клеток полностью потерявших способность к синтезу рРНК (нормобласты, дифференцированные энтероциты, клетки шиповатого слоя кожного эпителия и др.).
Часто они настолько малы и так окружены конденсированным хроматином, что с трудом обнаруживаются в световом микроскопе. В ряде случаев они могут снова активироваться и переходить в компактную или ретикулярную форму.
Сегрегированные ядрышки характерны для клеток, обработанных различными антибиотиками или химическими веществами, вызывающими прекращение синтеза рРНК (актиномицин Д, амфотерицин и др.), а также антибиотиками, влияющими на синтез ДНК и белков (митомицин, пуромицин, многие канцерогены и т.д.). Термин “сегрегация” используется в данном случае в связи с тем, что происходит как бы разделение, обособление разных компонентов ядрышек, сопровождающиеся прогрессивным уменьшением его объема. При этом обособляются друг от друга крупные фибриллярные центры и гранулярно-фибриллярный компонент.
Белки ядрышек
До 60% сухого веса выделенных ядрышек приходится на белки, число которых может составлять несколько сот разных видов. Помимо белков ассоциированного с ядрышками хроматина в состав
ядрышек входят белки рибосом и специфические ядрышковые белки, связанные с транскрипцией рибосомных генов, с процессингом 45S рРНК, такие как РНК-полимераза I, факторы транскрипции, топоизомеразы, метилазы, нуклеазы, протеинкиназы, фосфатазы. Часть ядрышковых белков имеет сродство к серебру, - аргентофильные белки: РНК-полимераза I, фактор транскрипциии UBF, нуклеолин (С-23), нуклеофозмин (ньюматрин или В-23).
Аргентофилия характерна для белков, обогащенных сульфгидрильными, дисульфидными связями. Как уже указывалось, четкой аргентофилией обладают интерфазные ядрышки и зоны ядрышковых организаторов на митотических хромосомах.
Собственно ядрышковые белки расположены в специфических местах их активности. Так РНК-полимераза I и фактор транскрипции рРНК UBF располагаются в фибриллярных центрах (ФЦ) и/или в плотном фибриллярном компоненте (ПФК).
Ag-фильным является также белок с мол. весом 195 кДа, представляющий собой большую субъединицу РНК-полимеразы I, участвующую
в синтезе рРНК. Этот белок локализуется в зоне фибриллярных центров, по их периферии. На плоскостных препаратах ядрышек аргентофилией обладают участки над осевой частью «елочек», непосредственно над расположением гранул РНК-полимеразы I. Кроме того, с помощью иммуноморфологических методов РНК-полимераза I обнаруживается в зоне ядрышковых организаторов митотических хромосом. Это обстоятельство не противоречит данным о том, что во время митоза транскрипция полностью прекращается. Вероятно, что во время митоза гены, нагруженные неактивной РНК-полимеразой I, переносятся весте с нею в области ядрышковых организаторов из одной клеточной генерации в другую.
Специфический для ядрышек белок фибрилларин (В-36, м.в. 34 кДа) располагается в ПФК, где он осуществляет процессинг пре-рРНК в комплексе другими РНП, в состав которых входит U3 мяРНК, необходимая для начального этапа процессинга 45S рРНК. Фибрилларин обнаруживается также в остаточных ядрышках – в «ядрышковом матриксе».
Белок С23 (110 кДа) или «нуклеолин» локализуется в зоне плотного фибриллярного компонента и в фибриллярных центрах ядрышек, но также и в зонах ядрышковых организаторов митотических хромосом. Следовательно он обнаруживается как на транскрибируемых, так и на неактивных участках рибосомных генов. В препаратах распластанных ядрышек он обнаруживается над транскрипционными единицами («елочками»), он обнаружен во фракциях, содержащих предшественники рибосом. Функции его до конца не ясны, хотя стало известно, что белок С23 может играть важную структурную роль в процессе транскрипции: он своим N-концом, на котором находятся лизиновые группы, связывается с ядрышковым хроматином, а C-концом с транскрибируемым спейсером (tsi) на 45S рРНК.
Обнаружено, что этот белок связывается не с ДНК транскрипционной единицы, а с ДНК, имеющей нуклеосомное строение (вероятно со спейсерными участками).
Белок В-23 (нуклеофозин, м.в. 37 кДа) с помощью иммуноцитохимических методов локализован в области ПФК и, главным образом, в
зоне гранулярного компонента. Считается, что В-23 участвует в промежуточных и терминальных стадиях биогенеза рибосом, и в транспорте пре-рибосом.
Общая схема работы ядрышка как специального локуса синтеза рибосом
При становлении синтеза рРНК в ядрышках на поверхности ФЦ происходит активация транскрипционных единиц, - связывание с факторами транскрипции и РНК_полимеразой I, которая начинает считывать первичный транскрипт рРНК. По мере прохождения первой РНК-полимеразы I, на освобождающемся участке транскрипционной единицы садится следующая РНК-полимераза и начинается синтез новой рРНК. Одновременно и последовательно на одном р-гене могут находиться до сотни РНК-полимераз I, от которых отходят транскрипты разной степени завершенности. Конечным продуктом является пре-рРНК или 45S рРНК. По мере синтеза растущие цепи рРНК одеваются рибосомными белками, поступающими в ядро из цитоплазмы, так что сразу образуются цепи РНП-предшественников. Совокупность продуктов транскрипции нескольких транскрипционных
единиц образует вокруг ФЦ зону ПФК. Конечным продуктом такого синтеза является рибонуклеопротеидный тяж, или глобула, имеющая константу седиментации около 80S, содержащая одну молекулу 45S рРНК. После отделения 45S рРНК в терминальной точке транскрипционной единицы происходит расщепление – процессинг 45S рРНК, в конце которого образуются 40S и 60S рибосомные субъединицы. Синтез малых субъединиц в ядрышке занимает примерно 30 мин, а больших – около 1 ч. В ядрышке незрелая 60S рибосомная субъединица, коме двух фрагментов рРНК (28S и 5,8S) связывается с третьим (5S), который синтезировался независимо от хромосом с ядрышковыми организаторами на других хромосомах. Такие новообразованные рибосомные субъединицы особым образом выходят из ядра в цитоплазму через ядерные поры. В цитоплазме такие незрелые рибосомы могут связаться с дополнительными белками. 40S субъединица сначала связывается с иРНК, и только затем с большой 60S субъединицей, образуя полную 80S функционирующую рибосому (рис. 92).
Новые, неканонические функции ядрышек
Последние данные показывают, что кроме синтеза рРНК, ядрышко участвует во многих других аспектах экспрессии генов.
Первые намеки (1965) на признаки полифункциональности ядрышек были получены при изучении гетерокарионов. Так при слиянии человеческих клеток HeLa с эритроцитами кур были получены гетерокарионы с первоначально совершенно разными ядрами. Ядра клеток HeLa были функционально активны, в них шел синтез разнообразных РНК. Исходные ядра эритроцитов кур содержали сверхконденсированный хроматин, не содержали ядрышек и не транскрибировались. В гетерокарионе после слияния с HeLa клетками в ядрах эритроцитов кур хроматин начинал деконденсироваться, активировалась транскрипция, появлялись ядрышки. Иммуноцитохимическими методами изучалось появление в гетерокарионах белков, характерных для куриных клеток. Несмотря на то, что в клетках HeLa была готовая система функционирования рибосом и были сформированы ядрышки, появление куриных белков было отложено до тех пор
пока не возникнут ядрышки в ядрах эритроцитов. Это означало, что ядрышко куриного эритроцита как-то должно вовлекаться в образование куриных иРНК, т.е. ядрышко должно играть какую-то роль в продукции куриных иРНК.
Позднее были накоплены данные в поддержку этой возможности. Было обнаружено, что созревание (сплайсирование, см. ниже) c-myc иРНК в клетках млекопитающих происходит в ядрышках. В ядрышках обнаружены сплайсосомные малые РНК (sn РНК), факторы сплайсинга пре-иРНК.
Далее в ядрышках обнаруживаются РНК, входящие в SRP-частицы, участвующие в синтезе белков в эндоплазматическом ретикулуме. С ядрышком оказалась ассоциирована РНК теломеразы – рибонуклеопротеида (обратная транскриптаза). Много есть данных о локализации в ядрышках прцессинга малых ядерных РНК, входящих в состав сплайсосом, и даже о процессинге тРНК.
Ядрышко во время митоза: периферический хромосомный материал
В световом микроскопе ядрышко выявляется во время интерфазы,
в митотических клетках оно исчезает. При использовании цейтраферной микрокиносъемки можно наблюдать в живых клетках как по мере конденсации хромосом в интерфазе происходит исчезновение ядрышка. Сначала оно слегка уплотняется, но затем ко времени разрыва ядерной оболочки начинает быстро терять плотность, становится рыхлым и на глазах быстро исчезает, как бы тает. При этом видно, что часть ядрышкового материала растекается между хромосомами. В метафазе и анафазе ядрышки как таковые отсутствуют. Первые признаки новых ядрышек появляются после средней телофазы, когда уже достаточно разрыхлились хромосомы дочерних ядер, имеющие новую ядерную оболочку. В это время вблизи деконденсирующихся хромосом появляются плотные тельца – предъядрышки. Обычно их число выше, чем число ядрышка в интерфазе. Позднее уже в G1-периоде клеточного цикла предъядрышки растут, начинают объединяться друг с другом, их общее число падает, но суммарный объем возрастает. Общий объем ядрышка удваивается в S-G2-фазах. В некоторых случаях в профазе
(культуры клеток человека) при конденсации хромосом крупные ядрышки распадаются на более мелкие, которые в митозе исчезают.
На самом деле никакого полного исчезновения, или «растворения» ядрышка нет: происходит изменение его структуры, редукция одной части его компонентов при сохранении другой. Так было показано, что аргентофильные гранулы в интерфазных ядрышках, обнаруживаемые в световом микроскопе начинают в профазе сливаться друг с другом, одновременно уменьшаясь в объеме, минимальный размер они занимают в метафазе, локализуясь в зонах ядрышковых организаторов хромосом. В таком виде они существуют до средней телофазы, когда выявляются в виде отдельных множественных «предъядрышек», разбросанных среди деконденсированных хромосом. Уже в конце телофазы такие аргентофильные предъядрышки начинают расти. Таким образом можно видеть, что во время митоза исчезновению подвергается только часть ядрышкового компонента, в то время как аргентофильный компонент сохраняется, постоянно существует во время митоза
и переносится на хромосомах в дочерние ядра.
Радиоавтографическими исследованиями было показано, что исчезновение ядрышек совпадает с прекращением синтеза клеточной (в основном рибосомной) РНК, который возобновляется в поздней телофазе, совпадая по времени с появлением новых ядрышек.
Кроме того было обнаружено, что активность РНК-полимеразы I также исчезает на средних стадиях митоза. Это давало основание считать, что новообразование ядрышек связано с восстановление синтеза рРНК в дочерних клетках.
Но с другой стороны существуют факты, указывающие на перманентное, постоянное присутствие ядрышковых компонентов течение всего клеточного цикла. Это относится к Ag-фильному материалу ядрышек в первую очередь.
Во время митоза у животных и растений хромосомы окружены матриксом, представляющем собой скопление рыхло расположенных фибрилл и гранул рибонуклеопротеидов, сходных по составу с компонентами, входящими в состав интерфазных ядрышек.
При конденсации хромосом часть ядрышек диссоциирует и уходит в цитоплазму (большая часть РНП-частиц), в то время как другие тесно связываются с поверхностью хромосом, образуя основу «матрикса», или периферического хромосомного материала (ПХМ).
Этот фибриллярно-гранулярный материал, синтезированный до митоза, переносится хромосомами в дочерние клетки. В ранней телофазе еще в отсутствие синтеза РНК по мере деконденсации хромосом происходит структурное перераспределение компонентов ПХМ. Его фибриллярные компоненты начинают собираться в мелкие ассоциаты – предъядрышки, которые могут сливаться друг с другом, собираться в зоне ядрышкового организатора хромосом в поздней телофазе, где возобновляется транскрипция рРНК.
Ядрышковые белки, участвующие в транскрипции рРНК (РНК-полимераза I, топоизомераза I, фактор инициации транскрипции UBFи др.), аккумулируются в зоне ядрышкового организатора, в то время как белки, связанные с процессингом пре-рРНК (фибрилларин,
нуклеолин, В-23), а также некоторая часть пре-рРНК и малые ядрышковые РНП переносятся поверхностью хромосом в составе периферического хромосомного материала.
Кроме того в состав ПХМ могут входить некоторые негистоновые белки из состава ядерного интерфазного остова.