Биохимия
Раздел о химическом составе живых клеток и организмов и о химических процессах, лежащих в основе их жизнедеятельности
» Вода
» Фотосинтез
» Цикл Кребса
» Витамины
Белки
В этом разделе описываются известные данные о белках
Аминокислоты
* - незаменимые для человека аминокислоты
pI – изоэлектрическая точка (pH при котором аминокислота нейтральна)
3-D структура двадцати аминокислот: AminoAcids.pdb [20Kb]
Модификации аминокислот
ацилирование – добавление Ac к -R–NH акт Lys и Arg с нейтрализацией ‘-‘ заряда
фосфорилирование – добавление остатка фосфорной к-ты к –OH группе нейтральных полярных акт Ser и Thr c приобретением ‘–‘ заряда
метилирование
Lys и Arg ‘–‘ заряж акт нейтрализация заряда, может быть моно-, ди-, и триметилирование, т.е различная степень нейтрализации
поли ADP-рибозилирование
убиквитинирование
К сожалению, список литературы отсутствует.
| Прикрепленный файл | Размер |
|---|---|
| AminoAcids.rar | 19.91 кб |
Классификация
Белки классифицируются по своему составу, структуре и функциям.
ПО СОСТАВУ
Простые (протеины) состоят только из аминокислот (яичный альбумин, кератин шелка)
Сложные (протеиды) состоят из полипептидной цепи и небелкового компанента, в зависимости от которого называются:
металлопротеиды - содержат ионы металлов (многие ферменты);
гемопротеиды - содержат гем с ионом металла (гемоглобин, каталаза, цитохромы);
фосфопротеиды - содержат остатки фосфорной кислоты (казеин молока);
липопротеиды - содержат липиды (родопсин);
гликопротеиды - содержат углеводы (иммуноглобулины);
нуклеопротеиды - комплекс белка с нуклеиновыми кислотами (хроматин, рибосомы).
ПО СТРУКТУРЕ
Фибриллярные (нитевидные) - имеют только выраженную вторичную структуру, нерастворимы в воде, выполняют структурную, сократительную функции (коллаген, кератин)
Глобулярные - имеют молекулу в виде шарика (глобулы), хорошо выраженную третичную структуру, растворимы в воде, выполняют сложные функции - каталитическую, регуляторную, защитную и др. (фермент триозофосфатизомераза - рис., гормоны, гемоглобин)
Мембранные : Также имеют молекулу в виде шарика (глобулы) и хорошо выраженную третичную структуру, но не растворимы в воде за счет гидрофобных участков, взаимодействующих с липидами мембран, выполняют транспортную (сквозь мембрану) и сигнальную функции (порин, родопсин)
ПО ФУНКЦИЯМ
1. Каталитическая
Ферменты (энзимы) - увеличивают скорость протекания химических реакций (каталаза, пепсин, трипсин)
2. Транспортная
Перенос веществ (гемоглобин, липопротеины крови, сывороточный альбумин - транспорт жирных кислот, пермеазы - мембранные белки осуществляющие избирательный транспорт заряженных и полярных молекул.)
3. Регуляторная
Гормоны белковой природы (АКТГ, инсулин, соматотропный), активаторы и репрессоры транскрипции.
4. Сигнальная, трансформация энергии
Белки, реагирующие на внешние сигналы (родопсин, рецепторы вкуса). Белки преобразующие один вид энергии в другой.
5. Запасная
Яичный альбумин, казеин молока. Белки разрушаясь в организме идут на построение других белков или получение энергии
6. Структурная
Белки составляют основу всех клеточных органелл, являются структурным компанентом межклеточного вещества (коллаген - компанент соединительной ткани, кератин - образует волосы, ногти, рога, копыта).
7. Сократительная
Белки мышечной ткани (актин, миозин).
8. Защитная
Иммуноглобулины; фибриноген плазмы (свертывание крови).
9. Токсины
Яды белковой природы (чаще всего - ферменты по механизму действия, как змеиные яды); дифтерийный и ботулинический токсины.
10. Буферная
Белки являясь амфотерными полиэлектролитами способствуют поддержанию определенного pH в различных частях клетки.
К сожалению, список литературы отсутствует.
Строение белков
Число возможных пептидов 20n n - количество аминокислот в пептиде.
Белки составляют ~1/2 сухой массы клетки
вторичная структура обусловлена H-связями между NH и CO скелета первичной структуры и не зависит от –Rтретичная структура зависит от взаимодействия между R: S-S-связи, ионные, Н-связи, гидрофобные взаимод
Полипептидные структуры
a-спираль
число остатков на один оборот 3,6
шаг 0,54нм (диаметр спирали 5,4 A)
радиус 0,23нм
угол 260
коэф. трансляции 0,15нм (расстояние между остатками по оси 1,5A)
угол поворота 1000
периодичность 5
запрещенные положения а-спирали: 1,2; 1,4; 1,5 – не должно быть больших гидрофобных аминокислот (Tyr-Tyr, Val-Tyr, Ile-Tyr) – спираль будет напрягаться и искажаться
спираль мб лево- и правозакрученная, все исследованные белки правозакрученные
длина как правило ~40A, но достигает 1000A
две или более спирали могут закручиваться вокруг как в канате – а-спирализованная суперспираль (кератин волос, миозин,
тропомиозине мышц, фибрине)
в-слой
параллельный и антипараллельный (более устойчивый)
спираль коллагена
в-изгиб
в глобулах направление цепей меняется на 1800 – СO присоединяется ч-з 3а-кты к NH
Изгибы обеспечиваются Pro, или большими гидрофобными аминокислотами: Tyr, Val, Ile.
В полипептиде вращение возможно вокруг любой связи | Гидрофобная внутренняя часть плотно упаковывается (как кристалл) образуя кор, гидрофильная внешняя часть белка образует сложную поверхность | Белки делятся на глобулярные-95% и фибриллярные-5% | большинство глобулярных б р-римо, а фибриллярных нер-римо | модели белков: объемная, скелетная, лентовидная, сосисочная-показ. ход полипептидной цепи | Конформацию белка можно определить только с помощью рентгеноструктурного анализа белков | связи в полипептиде: м-у заряж. актами, водородные, S-S-связи | В цитозольных белках S-S-связей мало из-за высокой конц глутатиона кот. восстанавливает SH-группы||
-слой образ. сердцевину (core) белков
антипараллельный -слой часто служит каркасом на кот собирается глобулярный белок
параллельный -слой часто бывает накрыт с 2-х сторон -спиралями
-спираль обнаружена в кератине | фенол денатурирует белки до первичной структуры | коагуляция - осаждение белков | этанол, ацетон, р-ры нек солей (MgSO4 (NH4)2SO4 Na2SO4) обратимо коагулируют белки, в воде снова образ коллоидный р-р. Необратимую коагуляцию (денатурацию) белка вызывает кипячение, минеральные кты, пикриновая кты, соли тяжелых ме, танин – необратимая коагуляция-денатурация
Протеины: альбумины хорошо р-ряются в воде (молоко, яичный белок, кровь); глобулины в воде не р-ряются, р-римы в разбавл р-рах солей (глобулины крови, миозин); глутелины р-ряются в разб щелочах (в растениях); склеропротеины — нер-римы (кератины, коллаген, белок натурального шелка фиброин) | Протеиды - протеины, соед с мол-лами др типа (простетические группы): фосфопротеиды сод мол-лы фосфорной кты, связанные в виде сложного эфира у ОН-группы серина (вителлин—белок
в яичном желтке, казеин); гликопротеиды сод остатки углеводов, входят в состав хрящей, рогов, слюны; хромопротеиды сод мол-лу окраш в-ва типа порфина (гемоглобин); нуклеопротеиды — связаны с нк (вирусы)
определение актного состава - метод гидролиза (6-10М HCl t100°С) получ смесь акт кот можно разделить | для кол-венного анализа применяют ионообменную и бумажную хроматографию Нек ф-ты расщеп белок специфически —в местах опред акты-->получ продукты ступенчатого расщепления — пептоны и пептиды, анализом кот опред актный состав | для опред послед-ти акт опредляют N- и С-концы пидных цепей определяя концевые акты и число пидных цепей. Для опред N-концов получают N-производное концевой акты, кот идентифицируют после полного гидролиза пептида. С-концы пептидных цепей опред избирательным отщеплением концевой акты с помощью ф-та — карбоксипептидазы и идентификацией этой акты Если белок из неск пептидов, то разрушают S-S-мостики окислением (над-муравьиной ктой) и затем полученные пиды
разделяют путем фракционирования на ионитах. Для определения последовательности расположения аминокислот в каждой полипептидной цепи ее подвергают частичному кислотному гидролизу и избирательному расщеплению с помощью ферментов, каждый из которых разрывает полипептидную цепь только в определенных местах присоединения какой-то одной определенной аминокислоты или одного типа аминокислот (основных, ароматических). Таким образом получают несколько наборов пептидов: которые разделяют, используя методы хроматографии и электрофореза. Строение коротких пептидов определяют последовательным отщеплением и идентификацией концевых аминокислот упомянутыми выше методами, а большие пептиды подвергают дополнительному расщеплению с последующим разделением и определением строения. Затем путем сложного сопоставления структуры различных участков пептидной цепи воссоздают полную картину расположения аминокислот в макромолекуле белка.
ОПРЕДЕЛЕНИЕ НАЛИЧИЯ БЕЛКА: биуретовая реакци, ксантопротеиновая
реакция (желтое окраш при действии конц HNO3, кот в присутствии аммиака становится оранжевым - нитрование остатков фенилаланина и тирозина); реакция Миллона (желто-коричневое окраш при действии с Hg(NI3)2+HNО3+HNO2, нингидриновая реакция, t белков с солями свинца-->черный осадок PbS если акты сод S, сильное нагревание вызывает разложение белков с выделением летучих продуктов, обладающих запахом жженых перьев.
К сожалению, список литературы отсутствует.
Ферменты
Ферменты - белки, обладающие каталитической активностью.
Ферменты являются функциональными единицами клеточного метаболизма.
Ферменты специфичны, т.е. катализируют только определенные реакции с участием специфических субстратов.
Субстрат -
Для работы всех ферментов необходимы специфические pH, температура.
Для работы некоторых ферментов достаточно полипептидной цепи из которой они состоят (рибонуклеаза поджелудочной железы), для работы других необходимы кофакторы - неорганические вещества (например, ионы Fe2+,Mn2+,Zn2+), или органические вещества - коферменты, или и то и другое.
Простетическая группа - коферменты прочно соединяющиеся с ферментом (гем гемоглобина).
Холофермент - каталитически активный фермент со всеми полипептидными цепями, кофакторами и коферментами.
Апофермент - белковая часть фермента без кофакторов и коферментов.
Кофакторы некоторых ферментов.
| ионы | фермент |
| Fe2+ или Fe3+ | цитохромоксидаза, каталаза, пероксидаза |
| Cu2+ | цитохромоксидаза |
| Zn2+ | ДНК-полимераза, карбоангидраза, алкогольдегидрогеназа |
| Mg2+ | гексокиназа, глюкозо-6-фосфатаза |
| Mn2+ | аргиназа |
| K+ | пируваткиназа (+Mg2+) |
| Ni2+ | уреаза |
| Mo | нитратредуктаза |
| Se | глутатионпероксидаза |
Классификация ферментов.
В соответствии с международной номенклатурой все ферменты делятся на шесть классов согласно их функции:
1. Оксиредуктазы - осуществляют перенос электронов.
2. Трансферазы - осуществляют реакции с переносом функциональных групп.
3. Гидролазы - реакции гидролиза (перенос функциональных групп на молекулу воды).
4. Лиазы - присоединение групп по двойным связям и обратные реакции.
5. Изомеразы - перенос групп внутри молекулы с образованием изомерных форм.
6. Лигазы - образование С-С, С-S, C-O и С-N связей за счет реакций конденсации, сопряженных с распадом ATP.
Каждый класс разделяется на подклассы и подподклассы обозначаемые цифрой через точку.
Подробная классификация ферментов на английском языке приведена здесь.
Выражение концентрации ферментов
Скорость ферментативных реакций
Зависимость скорости реакции от концентрации субстрата Механизм работы ферментов Ингибирование ферментов
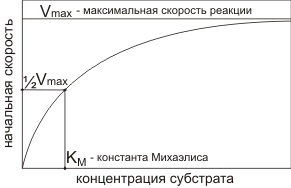 При повышении концентрации субстрата скорость реакции сначала возрастает линейно, затем выходит на плато.
При повышении концентрации субстрата скорость реакции сначала возрастает линейно, затем выходит на плато.
Максимальная скорость наступает когда субстрата слишком много и фермент не успевает с ним справиться. Максимальная скорость
недостижима, поэтому используют величину равную половине максимальной скорости. Концентрация субстрата при которой начальная скорость равна половине от максимальной называется константой Михаэлиса.
Константы Михаэлиса некоторых ферментов
фермент
субстрат
Км, мМ
каталаза
H2O2
25
гексокиназа
ATP
0,4
D-глюкоза
0,05
D-фруктоза
1,5
карбоангидраза
HCO3-
9
химотрипсин
глицил-тирозинил-глицин
108
N-бензоилтирозинамид
2,5
b-галактозидаза
D-лактоза
4,0
треониндегидратаза
L-треонин
5,0
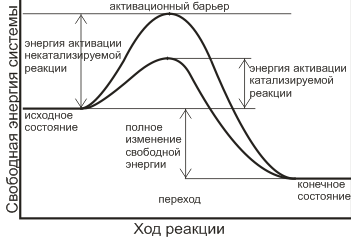
К сожалению, список литературы отсутствует.
Гликолиз, гликогенолиз, глюконеогенез
Гликолиз- ферментативный анаэробный процесс негидролитического распада углеводов (глюкозы) до молочной кислоты. Обеспечивает клетку энергией в условиях недостаточного снабжения кислородом.
Гликолиз - единственный процесс поставляющий энергию у облигатных анаэробов. В аэробных условиях гликолиз предшествует дыханию - окислительному распаду углеводов до CO2 и H2O.
Гликолиз проходит в цитоплазме клетки.
Кроме глюкозы в процесс гликолиза могут вовлекаться другие гексозы (манноза, галактоза, фруктоза), пентозы и глицерин.
Гликогенолиз - процесс гликолиза у животных при котором субстратом служит гликоген. В процессе гликогенолиза, наиболее интенсивно протекающем в мышцах при распаде одной молекулы глюкозы образуется 3 молекулы ATP.
Все реакции гликолиза обратимы, кроме 1-й, 3-й и 10-й. 3-я реакция является лимитирующей скорость гликолиза, активность фосфофруктокиназы усиливается AMP и ADP и подавляется ATP
и лимонной кислотой.
Глюконеогенез - процесс образования глюкозы из неуглеводных предшественников. Глюконеогенез реализуется путем обращения большинства cтадий гликолиза.
 Общая схема гликолиза
Общая схема гликолиза
Нуклеиновые кислоты
Раздел посвящённый основе всего живого - нуклеиновым кислотам - нерегулярным биополимерам
ДНК
структура ДНК
формы ДНК
нуклеотидный состав ДНК
плавление ДНК
топология ДНК
ДНК - молекула, состоящая из двух антипараллельных молекул соединенных водородными связями по принципу комплементарности с образованием спиральной структуры.
Структура ДНК
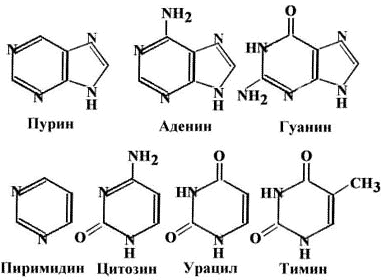
Структурной единицей цепи ДНК является дезоксирибонуклеозид, состоящий из фосфата, сахара-дезоксирибозы и четырех нуклеотидов: аденина (A), цитозина (C), гуанина (G) и тимина (T). У некоторых фагов Тимин замещен Урацилом (фаг PBS1), который обычно входит в состав РНК. Нуклеотиды двух цепей ДНК соединены водородными связями по принципу комплементарности: А-T, G-C.пурины (2кольца) -Аденин, Гуанин пиримидины -Тимин, Цитозин |
d DNA=20A; - на пурин-12A, на пиримидин-8A |
В паре A-Т 2 H-связи, в паре Г-Ц – 3 |
Вращающаяся молекула ДНК [1 Mb]
Tаутомерия оснований
В гетороциклах протоны связанные с азотом могут переходить
на другие атомы азота или на атомы кислорода кетогруппы и в растворах будет существовать равновесие различных таутомерных структур быстро переходящих друг в друга.
В результате таутомерых превращений U и G в енольной форме при спаривании могут имитировать С и А, а С и А в иминоформе - U и G, что может привести к мутациям в ДНК (рис.).
Стекинг взаимодействие
Основания в цепи ДНК лежат друг над другом в стопке, что обеспечивает дополнительную стабилизацию цепи - стекинг взаимодействие.
Величина стекинг взаимодействия между основаниями: пурин-пурин>пиримидин-пурин>пиримидин-пиримидин
В олиго- и полинуклеотидах стэкинг между соседними основаниями приводит к формированию стабильной одноцепочечной спиральной структуры (polyA) а отсутствие стекинга к разупорядоченному клубку (polyU)
Энергия стекинг взаимодействий ~ -3 - -15 ккал/моль
Сахарофосфатный остов снаружи основания внутри дезоксиробозофосфаты соединены фосфодиэфирными связями. ОН-группы фосфата соединены
с ОН-группой 3'- и 5'-углеродами дезоксирибозы.
Ошибочное спаривание может происходить, когда тимин находится в енольной форме или цитозин находится в имино форме.
 Напишите здесь подпись к рисунку
Напишите здесь подпись к рисунку Модификации нуклеотидов
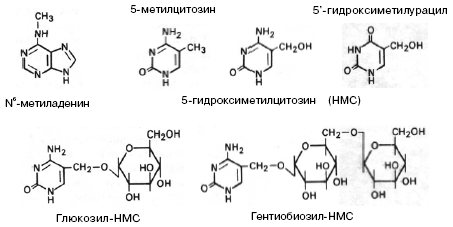 рис.1 Модифицированные нуклеотиды [Сингер].
рис.1 Модифицированные нуклеотиды [Сингер]. Нуклеотиды в ДНК могут подвергаться модификациям: 5-метилцитозин,
5-гидроксиметилцитозин, 5-гидроксиметилурацил,
N-метиладенин. В ДНК некоторых бактериофагов к гидроксиметильной группе гидроксиметилцитозина присоединены с помощью гликозидной связи моно- или дисахариды. ДНК большинства низших эукариот и беспозвоночных содержат относительно мало 5-метилцитозина и
N6-метиладенина. У позвоночных метилирование оснований играет
важную роль в регуляции экспрессии генов, причем наиболее распространен 5-метилцитозин. Показано, что
более 95% метильных групп в ДНК позвоночных содержится в остатках цитозина редко встречающихся CG-динуклеотидов и более 50% таких динуклеотидов метилировано. У растений 5-ме-тилцитозин можно обнаружить в динуклеотидах CG
и тринуклеотидах CNG (N – C, А или Т).
Формы ДНК
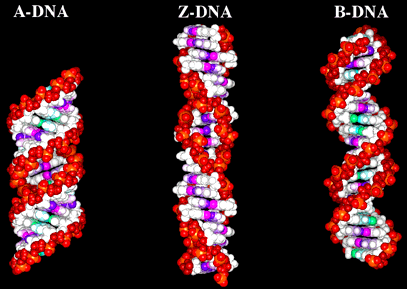
| Параметры | B-форма | А-форма | С-форма | Z-форма |
| спираль | правозакручена | правозакручена | правозакручена | левозакручена |
| ед. повтора | 1 пн | 1пн | 1пн | 2пн |
| пн в обороте | 10,4 | 10,7 | 9.3 | 12 |
| диаметр | 23,7А | 25,5А | 18,4А | |
| вращение/пн | 35,9 | 33,6 | 38,7 | 60/2 |
| наклон пн к оси | -1,2 | +19 | -9 | |
| раст. м-у пн вдоль оси | 0.332 nm | 0.23 nm | 0.38 nm | |
| длина оборота | 34А | 28А | 31А | 34,4А |
При исследовании ДНК различными методами обнаружено наличие различных форм ДНК образуемые при различных условиях (концентрации солей, влажность), некоторые из которых способны существовать в живых организмах.
Существуют A, B, C, D, T-семейства форм ДНК, которые могут быть подразделены на различные подтипы (C', C'').
В-ДНК - основное состояние ДНК показанное на кристаллах и в водных растворах.
С-ДНК - форма существующая при пониженной концентрации Na и влажности 44-66%, если GC=31-72%.
А-ДНК - такая форма образуется у гибридов ДНК-РНК, следовательно при транскрипции ДНК переходит в А-форму, в месте контакта RNA-pol. Для этой формы характерно наличие внутренней пустоты диаметром 5A.
Z-ДНК - левозакрученная формаПереходу B-->Z способстует наличие GC-5' последовательности являющейся местом метилирования у организмов. Такие последовательности в плазмидах при сверхспирализации переходят из B в Z форму.
При B-->Z переходе участок в 11 пн имеет переходную форму между левой и правой спиралью.
Z-ДНК обнаружена в междисках политенных хромосом D. melanogaster.
Полинуклеотид GC-5' находясь в В-форме при низкой концентрации соли образует нуклеосомы. При высоких концентрациях соли полинуклеотид GC-5' переходит в Z-форму которая не образует нуклеосом.
А-, Z- формы не могут существовать в водном растворе без дополнительных воздействий (белки, суперспирализация).
D-DNA - AT-богатые участки ДНК фага Т2, у которого цитозин заменен на 5'-гидроксиметилцитозин, единственная из известных природных ДНК находится в D-форме. Кроме того ДНК фага гликозилирована более чем на 70%.
Двойная спираль D-ДНК закручена сильнее чем B-ДНК и имеет глубокий малый желоб - удобнуюю полость для размещения воды и катионов.
 3D-структуры ДНК
3D-структуры ДНК Искривление ДНК
Нуклеотидный состав ДНК
Правила Чаргафа
Нуклеотидный состав ДНК некоторых
организмов [Сингер].
| Источник | А | G | C | T | A+T/G+C | A+G/T+C | G+C, мол.% |
| Бактериофаг λ Бактериофаг Т2 Escherichia coli Bacillus subtilis Вирус папилломы Шоупа Saccharomyces cerevisiae Chlamydomonas Цыпленок Мышь Корова Пшеница |
26,0 32,5 23,8 29,0 26,6 31,3 19,6 27,9 28,9 27,3 27,2 |
23,8 18,2 26,0 20,7 24,5 18,7 30,2 21,2 21,1 22,5 22,6 |
24,3 16,72 26,4 21,3 24,2 17,1 30,0 21,5 20,3 22,5 22,8 |
25,8 32,6 23,8 29,0 24,7 32,9 19,7 29,4 30,0 27,7 27,4 |
1,08 1,86 0,91 1,38 1,05 1,79 0,65** 1,34** 1,44** 1,22** 1,20** |
0,99 1,03* 0,99 0,99 1,04 1,00 0,99** 0,96** 1,00** 0,99** 0,99** |
48 35* 52 42 49 36 60** 43** 41** 44** 45** |
* 5-гидроксиметилцитозин
** включая 5-метилцитозин
У эукариот частота встречаемости 5'-CG-3'выше, чем 5'-GC-3', т.к. динуклеотид 5'-GC-3' подвергается метилированию, участвующему в регуляции экспрессии генов. У прокариот соотношение 5'-CG-3'/5'-GC-3' близко к случайному (см.таблица).
| Источник | 5'-CG-3'/5'-GC-3' | 5'-AG-3'/5'-GA-3' |
| Вирусы бактерий λ Т2 Бактерии Escherichia coli Micrococcus lysodeikticus Bacillus subtilis Вирусы животных SV40 Полиомавирусы Вирус папилломы Шоупа Одноклеточные эукариоты Saccharomyces cerevisiae Chlamydomonas Многоклеточные эукариоты Цыпленок Человек Мышь Корова Пшеница |
1,02 0,82 0,95 1,15 0,82 0,14 0,35 0,44 0,87 0,68 0,21 0,23 0,23 0,36 0,78 |
0,90 0,96 1,0 0,75 0,87 1,35 1,28 1,16 0,96 1,36 1,28 1,15 1,15 1,10 0,97 |
Размер молекул ДНК
Размер ДНК выражается в парах нуклеотидов (пн), или в тысяче пар нуклеотидов (тпн)
| Источник | М, Да | Длина | пн | Тип структуры |
| Бактериофаг φХ174 SV40 Бактериофаг Т2 Хромосома Hemophilus influenzas Хромосома Escherichia coli Saccharomyces cerevisiae Хромосома 1 Хромосома 12 Drosophila melanogaster Хромосома 2 Хромосома 3 Хромосома 4 |
1,6•106 3,5•106 1,2•108 7,9•108 2,6•108 1,4•108 1,5•109 4•1010 4,2•1010 4•109 |
1,6 мкм 1,1 мкм 50 мкм 300 мкм 1 мм 50 мкм 500 мкм 15 мм 16 мм 1,5 мм |
5•103 5,2•103 2•105 1,2•106 4•106 2,1•105 2,2•106 6,0•107 6,3•107 6•106 |
Кольцевая одноцепочечная Кольцевая двухцепочечная Линейная двухцепочечная Неизвестен Кольцевая двухцепочечная Линейная двухцепочечная Линейная двухцепочечная Линейная двухцепочечная Линейная двухцепочечная Линейная двухцепочечная |
Плавление ДНК
Денатурация или плавление - расхождение цепей ДНК при нагревании ДНК ~1000C или при повышении pH.
Расхождение цепей происходит из-за разрушения слабых водородных
связей и плоскостных взаимодействий между основаниями.
На денатурацию также влияют: ионы одно- и двухвалентных металлов, белки, нейтрализующие отрицательные заряды фосфатных групп.
Температура плавления ГЦ выше чем АТ. Для разрушения двух Н-связей АТ-пар требуется меньше энергии, чем для разрыва трех H-связей GС-пар, значения температуры и рН, при которых происходит денатурация, зависят от нуклеотидного состава ДНК.
кривая плавления ДНК
Денатурация – процесс обратимый, последующее восстановление двухцепочечной структуры ДНК может происходить даже при полном расхождении цепей. Процесс воссоединения, называемый ренатурацией, реассоциацией или отжигом, происходит при
понижении температуры или рН
При резком понижении температуры или рН правильное воссоединение комплементарных цепей затрудняется из-за спари-
вания оснований локально комплементарных участков в пределах одной или разных цепей.
Ренатурация ДНК происходит при температупе на ~200C ниже температуры плавления.
При ренатурации сначало соединяются участки цепей с повторенной ДНК и затем с уникальными участками
кривая ренатурации ДНК
кривая зависимости т плав от конц. соли
Свойства ДНК
Ультразвук режет ДНК на равные фрагменты ~500 пн в длину.
ДНК нерастворима в неполярных растворителях.
Щелочь гидролизует ДНК.
Благодаря заряду фосфатных групп, ДНК имеет отрицательный заряд.
Топология молекул ДНК
- Сингер: Гены и геномы т.1
- Зенгер.В: Принципы структурной организации нуклеиновых кислот. М., Мир, 1987
РНК
gRNA - геномные(10000-100000н) | mRNA - информационные (матричные) (100-100000н) | tRNA - транспортные (70-90н) | rRNA – рибосомные-неск дискретных классов от 100 до 500000н | sRNA - малые (100-300н)
К сожалению, список литературы отсутствует.
Просмотр 3D-молекул
 Пример структуры как она выглядит в программе
Пример структуры как она выглядит в программе
Для просмотра 3D-молекул необходимо закачать архив программы RasWin и распаковать его на ваш компьютер.
Теперь вы можете просматривать изображения молекул в формате .pdb
Чтобы попробовать закачайте файл cellulos.pdb
Если у вас не получается открыть закаченный файл щелкните по нему правой кнопкой мыши, выберете в меню - открыть с помощью, выбрать программу, обзор, отыщите RasWin, укажите всегда открывать файлы такого типа этой программой.
Некоторые файлы вы сможете найти на нашем сайте в соответствующих обзорах.
Файлы можно также искать в базе данных Protein Data Base (PDB). Для того чтобы найти интересующую вас структуру необходимо в окне поиска набрать код структуры или название, например, 132L - лизоцим. В открывшемся окне, найти ссылку на файл .pdb, который откроется в окне вашего браузера. Скопируйте весь текст в блокнот и сохраните как name.pdb (не забудьте изменить при сохранении 'текстовые файлы' на 'все файлы', чтобы изменить разрешение). Приятного вам просмотра!
Для атомов пространственных моделей приняты следующие цвета:
H - белый, O - красный, С- серый, N - синий, P - оранжевый, S - желтый.
Коды некоторых интересных структур
132L - Лизоцим
1AAY - Цинковый палец
1COO - РНК-полимераза
1BBE - Коллаген
1C3W - Бактериородопсин
1HGA - Гемоглобин
7ICG - ДНК-полимераза
1A29 - Кальмодулин
1A0S - Порин
1C1G - Тропомиозин
1I6H - РНК-полимераза II синтезирующая РНК по матрице ДНК. Двухцепочечная ДНК входит в фермент, раскручивается перед активным центром фермента. В пределах активного центра существует дуплекс ДНК-РНК длинной 9 пн. 3'-конец РНК располагается над порой, через которую РНК выходит из фермента. Виден желоб в который входит и выходит ДНК и выходит РНК.
| Прикрепленный файл | Размер |
|---|---|
| cellulos.pdb | 5.51 кб |
| raswin.exe_.gz | 244 кб |