Протеасомы
Стабильность белков и время их жизни является важным параметром в различных клеточных процессах и зависит от многих факторов, таких как наличие специфических последовательностей (например, сайт разрушения циклинов), наличие специфического N-конца (например, белки с основными аминокислотами на N-конце менее стабильны), или посттрансляционные модификации (например, фосфорилирование, убиквитинирование).
Разрушение белков происходит в лизосомах и протеасомах - в лизосомах разрушаются внеклеточные и мембранные белки посредством эндоцитоза, в протеасомах разрушаются внутриклеточные белки.
Протеасома построена из центрального кора, состоящего из 14 белковых димера, по 7 в кольцевой структуре. Всего 4 кольца расположенных друг над другом; две регуляторные части с двух сторон от кора, 14 белков в каждой, 6 из которых ATP-азы. Некоторые из субъединиц узнают убиквитин - белок, состоящий из 76 аминокислот. (рис.1).
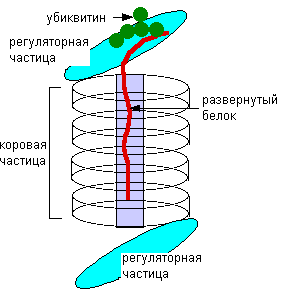
рис.1 Схема протеасомы.
Белок подвергающийся протеолизу соединяется лизиновым остатком с С-концом убиквитина (рис.2), дополнительные молекулы убиквитина присоединяются формируя цепь, которая связываетя с регуляторной частью протеасомы. Степень убиквитинирования имеет разные последствия для белка. Например, 48 остатков убиквитина присоединенные к белку служат сигналом протеасомного разрушения, тогда как 63 остатка служат посттрансляционным сигналом в различных клеточных процессах, таких как ДНК репарация, актвация транскрипционных факторов и др.
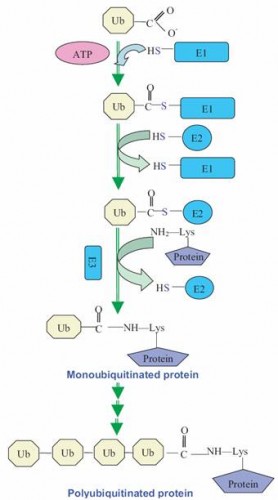
рис.2 Схема присоединения убиквитина к белку и участие различных ферментов.
Фермент Е1 активирует С-конец убиквитина, используя энергию АТФ, аденилированием и переносом тиоэфирной связи с цистеина на E1. Фермент Е1 переносит убиквитин к транспортноми ферменту Е2, который при помощи Е3 лигазы присоединяет его к субстрату.
Было обнаружено несколько генов кодирующих Е1, десятки генов Е2 и сотни Е3. Используя разные комбинации ферментов клетка регулирует какой белок должен быть разрушен и скорость распада.
Развернутый белок перемещается в пространство коровой частицы, где специфически разрезается на короткие пептиды ~8 аминокислот, которые впоследствии могут быть разрушены пептидазами цитозоля.
Нобелевская премия по химии за 2004 год была получена Avram Hershko, Aaron Ciechanover и Irwin Rose за исследование убиквитинирования белков, ведущее к их протеолизу.
